
高考化學科考前20天沖刺大全(2009年)
一、高考化學復習易錯點和盲點匯集
(1)有機分子結構式中有幾個苯環要看清楚,千萬不要認為六邊形一定是苯環;
(2)量器書寫時不注明規格,滴定管書寫時不注明酸、堿式;
(3)第VIII、第IVA等容易寫錯;
(4)熱化學方程式不注明狀態,△H單位“kJ/mol”、 放熱為“―”、吸熱為“+”不寫;
(5)書寫電子式時,共價化合物忘了未成對電子,離子化合物中的陰離子與原子團離子忘了加中括號;
(6)多元弱酸電離、多元弱酸根離子水解:一步寫成和不寫可逆符號;
(7)離子反應方程式和化學反應方程式、元素符號和元素名稱、結構簡式和分子式、化學方程式和結構簡式要混淆;
(7)有機化學方程式書寫時,小分子往往要丟失;縮聚、加聚反應時反應條件和n不寫;
特別強調:只要你以大綱為依據,以教材為根本,扎扎實實打好基礎,以不變應萬變,并能針對自己的薄弱環節,采取有效的補救措施,你就大可不必為高考成績而過度地焦慮。
附:中學化學應試易錯點整理
1. 遷移不當,與事實不符:飽和NaCl溶液中,Cl2溶解度減小,但HCl還可以繼續溶解(實驗室制得干燥、純凈的氯氣)。
2. 思考問題過于理想化,不從實際出發:
(1)含醛基物質發生銀鏡反應,與新制Cu(OH)2反應,鹵代烴水解均需在堿性條件下進行;檢驗鹵代烴水解產物中有X-,需要用HNO3酸化,再加AgNO3;檢驗淀粉水解產物時,要先用堿中和硫酸,再利用新制氫氧化銅;
(2)苯與液溴反應,稀苯酚溶液與濃溴水反應;(3)NaHSO4固體中不存在SO42-只存在HSO4-;(4)不能用氣體物質除去另一種氣體;(5)不能配制bmL、PH=a的弱酸或弱堿溶液;
3. 思維定勢,觀察不仔細,分析不透徹
(1)有機分子結構式中有幾個苯環要看清楚,千萬不要認為六邊形一定是苯環;
(2)SO3在常溫下是一種晶體,不是氣體;
4. 規范書寫:
(1)量器書寫時不注明規格,滴定管書寫時不注明酸、堿式;
(2)第VIII、第IVA等容易寫錯,
(3)熱化學方程式不注明狀態,△H單位為“kJ/mol”,放熱為“―”,吸熱為“+”;有機化學方程式書寫時用“→”,小分子切不可丟失;縮聚、加聚反應時條件和n不要丟;
(4)書寫電子式時,共價化合物不能忘了未成對電子,離子化合物中的陰離子與原子團離子不能忘了加中括號;
(5)多元弱酸電離、多元弱酸根離子水解:可逆符號和分步進行;
(6)淀粉和纖維素分子式都寫為(C6H10O5)n,但不是同分異構體,所以在分子式下面要用漢字注明;
(7)常見錯別字:酯化、油脂、炭化、褪色、加成、鈍化、氣體逸出、金剛石、銨鹽;
(8)在銀氨溶液中,Ag(NH3)2OH是以Ag(NH3)2+ 和OH?存在的;
(9)簡答題中的一些細節,如“打開活塞和止水夾”之類的描述不可忘;
(10)醛基、酯基、羧基的書寫要規范:“-CHO、-COOCH3、-COOH”;
5.幾個容易忽視的概念:
a.燃燒熱:抓住“1mol,完全燃燒,生成穩定氧化物”
b.中和熱:抓住“稀溶液,生成1mol水”
c.物質的量濃度:“溶液的體積”切不能把溶劑的體積當作溶液的體積;
d.同系物:“必須屬于同類物質---結構相似---相同官能團并且數量相等”;也要注意:

 它們就不屬于同系物;
它們就不屬于同系物;
e.結構式寫法不同,不能誤認為是同分異構。如:
f.計算化學反應速率時,濃度變化值除以單位時間,若求得物質的量的改變值,必須除以容器的體積,再除以時間;
g.能發生銀鏡反應的有機物不一定都是醛類物質,如甲酸、甲酸酯類也可發生銀鏡反應;
h.CaCO3、BaSO4是難溶物質,但溶解部分完全電離,屬于強電解質;
i.固體物質溶解是一個復雜的物理(擴散)化學(水合)變化,不是單純的物理變化;
6.PH計算時,稀釋酸溶液最終PH一定≤7,稀釋堿溶液最終PH≥7
7.其它易錯點:
(1)涉及有機物時通常對碳原子數小于4的為氣態,大于4的為液態和固態這一常識不了解
(2)求NA時,由體積轉化為物質的量時,一定要注意標態和氣體,但由質量轉化與狀態和標態無關;
(3)離子方程式和化學方程式容易混淆;求物質的質量和物質的物質的量容易混淆;A、B兩物質反應生成C的結構簡式錯寫成化學方程式;
(4)有毒氣體的檢驗和制取要在通風櫥中進行,并要進行尾氣處理;可燃性氣體做加熱條件下的實驗一定要驗純,否則要爆炸;
(5)填空式計算題,缺少物理量單位,如摩爾質量單位為“g/mol”,有效數字或保留幾位小數意識淡薄;
(6)要區分醇和酚:酚是-OH與苯環直接相連;
(7)Al2O3、Al(OH)3有兩性,一般要用強酸和強堿才能溶解;
(8)NaNO3中加入鹽酸,其實該體系中有H+、NO3-,當H+、NO3-共存時,具有強氧化性;
(9)做平衡類題目時,要先看清題給條件是恒壓還是恒容;
(10)檢驗物質要采用常用試劑,現象明顯,操作簡便。例:檢驗還原性物質一般用溴水、碘水、酸性KMnO4;檢驗氧化性物質常采用Na2S、KI(淀粉)溶液或試紙、FeCl2等(外加SCN-);
(11)合金一般熔點比各組分要低,硬度比各組分大;
(12)強酸、弱酸比較要看清起始濃度相同還是PH相同;
(13)氫鍵通常存在于HF、H2O、NH3、CH3CH2OH分子間;
(14)牢記原電池的負極和電解池的陽極失電子,電解時還要注意金屬電極本身失電子,寫電極反應式時還要考慮到兩極的氧化、還原產物與電解質溶液中的主要離子還能否發生反應;
(15)Al、Fe在常溫下在濃硫酸、濃硝酸中發生鈍化;
(16)物質相互之間反應,要注意題干中“少量”和“過量”的字樣;過量物質與新生成的物質能否相互反應,我們一定要考慮;
克服易犯的毛病:
1、計算結果無計量單位,或不能正確使用計量單位。如:要求表達摩爾質量時沒有寫計量單位,而要求回答相對分子質量時卻寫上了g/mol。
2、未看清要求回答什么。例如最后求的是各物質的質量,你卻求其物質的量;要求寫出元素名稱,你卻寫了元素符號;要求寫分子式,你卻寫了結構簡式;要求寫離子方程式,你卻寫了化學反應方程式;要求寫出A與B兩種有機物反應生成的化合物的結構簡式,或反應類型,你卻回答了它們的反應方程式。
3、計算題中往往出現“將樣品分為兩等份”(或“從1000mL溶液中取出50mL”),最后求的是“原樣品中的有關的量”,你卻只求了每份中的有關量。
4、解計算題時格式不規范,不帶單位運算,也不注意題中對有效數字的要求。建議大家盡量分步列式計算,因評分標準往往是分步給分的,你若列總式計算,結果正確倒無所謂,但一旦出現因運算錯誤而得不到正確答案時,那你就會失去全部的分。另外,有幾問,應分開回答,例:“求混合物的組成及其物質的量之比”,推算結果“混合物的組成”是CuO與Cu2O,物質的量之比為n(CuO):n(Cu2O)=2:1。有的同學推算后寫成n(CuO):n(Cu2O)=1:1,事實上他已把成分推導正確,能得到一部分的分數,但由于沒回答第一問,而第二問又答錯了,可能1分都拿不到。
5、熱化學反應方程式漏寫物質的聚集狀態,漏寫反應熱的“+”或“-”,寫錯反應熱的單位等。
6、化學反應方程式不配平,漏寫反應條件,不寫“↑”“↓”,可逆反應符號不寫。
7、寫有機化學方程式未用“→”,而用了“=”,漏寫反應條件。酯化反應的生成物漏寫“水”、縮聚反應的生成物漏寫“小分子”。
8、做完選擇題未及時填涂答題卡導致最后來不及涂卡或因時間短而涂錯。
9、有的同學習慣先在試卷上書寫,最后再譽寫到答題紙上,這樣有兩個弊端:一是費時,二是易漏寫填空題。
二、考前20天沖刺題
2.科學家將液態的金屬鎵(Ga)充入碳納米管中,發明出一種世界上最小的溫度計――碳納米管溫度計.該溫度計通過電子顯微鏡進行讀數,精確度較高,其測量范圍在
A.常溫常壓下鎵為液體
B.金屬鎵的體積在
C.碳納米管的體積在
D.Al(OH)3、Ga(OH)3均是兩性氫氧化物
3.人類對賴以生存的地球環境保護問題越來越重視,如何減少或取代高污染的化學品的使用,一直是許多化學家奮斗的目標,生產和應用綠色化工原料是達到該目標的最有效手段,碳酸二甲酯(簡稱DMC)是一種新化工原料,1992年在歐洲被譽為“非毒性化學品”,被譽為有機合成的“新基石”。下列關于DMC的說法正確的是
A.DMC結構簡式為
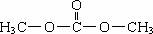
B.DMC在空氣中能燃燒,產物為CO2和H2O
C.DMC易溶于水,不溶于乙醇和丙酮
D.DMC用于生產非毒性化工產品,故被譽為有機合成的“綠色化工原料”
² 生活、生產、環境、農、工、醫
1.
A.硝基苯是一種油狀物質,會浮在水面上 B.實驗室制硝基苯需要用水浴加熱
C.硝基苯中毒是由蒸氣吸入或誤食引起的,與皮膚接觸不會引起中毒
D.硝基苯是由苯酚和硝酸直接反應生成的
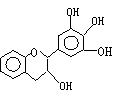 2.“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的純天然、多功能、高效能的抗氧化劑和自由基凈化劑。其中沒食子兒茶素(EGC)的結構如下圖所示。關于EGC的下列敘述中正確的是
2.“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的純天然、多功能、高效能的抗氧化劑和自由基凈化劑。其中沒食子兒茶素(EGC)的結構如下圖所示。關于EGC的下列敘述中正確的是
A、分子中所有的原子共面
B、1molEGC與4molNaOH恰好完全反應
C、易發生氧化反應和取代反應,難發生加成反應
D、遇FeCl3溶液不發生顯色反應
3.食品保鮮膜按材質分為聚乙烯(PE)、聚氯乙烯(PVC)、聚偏二氯乙烯(PVDC)等種類。PVC被廣泛地用于食品、蔬菜外包裝,它對人體有潛在危害。下列有關敘述不正確的是( )
A.PVC保鮮膜屬于鏈狀聚合物,在高溫時易熔化,能溶于酒精
B.PVC單體可由PE的單體與氯化氫加成制得
C.鑒別PE和PVC,可把其放入試管中加熱,在試管口放置一濕潤的藍色石蕊試紙,如果試紙變紅,則是PVC;不變紅,則為PE。
D.等質量的聚乙烯和乙烯燃燒消耗的氧氣相等
4.在2004年至2005年中,化學工作者和社會各界都一直關注食品安全問題,如“蘇丹紅1號”、“食品添加劑”、“火腿腸中保鮮劑”、“油炸薯類食品中的丙烯酰胺”等等。下列關于食品安全方面的說法正確的是
A.“蘇丹紅1號”的結構式為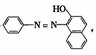 屬于甲苯的同系物,能使酸性KMnO4溶液褪色;
屬于甲苯的同系物,能使酸性KMnO4溶液褪色;
B.高溫油炸食品中含有一定量的CH2=CH-CO-NH2(丙烯酰胺),該物質能在一定條件下發生縮聚反應生成高分子化合物;
C.食品添加劑中種類很多,其中的一種為苯甲酸鈉,它是苯的同系物的一種所對應的鈉鹽;
D.火腿腸中保鮮劑通常用NaNO2,起抗氧化作用而達到保鮮的目的。
² 原子結構 物質結構 晶體結構(包括①原子序數、核電荷數、質子數、中子數、核外電子數及質量數之間的相互關系;②質量數、原子的原子量及元素的原子量的區別與聯系;③元素與同位素的聯系和區別;④微粒半徑大小的比較(主要是與原子序數之間的關系);⑤電子式的書寫(關鍵在于掌握書寫方法,以能夠寫出陌生物質的電子式⑥化學鍵類型和晶體類型的判斷;)。
1.下列取代基或粒子中,碳原子都滿足最外層為8電子結構的是
A.乙基(―CH2CH3) B.碳正離子[(CH3)
2.三硫化四磷分子的結構研究表明,該分子中沒有不飽和鍵,且各原子的最外層均已達到了8個電子的結構。在一個三硫化四磷分子中含有的共價鍵個數是
A.7個 B.9個 C.19個 D.不能確定
3.下列說法中正確的是
A.冰、水和水蒸氣中都存在氫鍵
 B.除稀有氣體外的非金屬元素都能生成不同價態的含氧酸
B.除稀有氣體外的非金屬元素都能生成不同價態的含氧酸
C.金屬離子和自由電子間通過金屬鍵形成的晶體是金屬晶體
D.CO2與SiO2都是分子晶體,所以它們有接近的熔、沸點
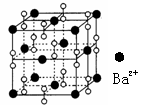
4.鋇在氧氣中燃燒時的得到一種鋇的氧化物晶體,其結構如下圖
所示,有關說法正確的是
A、該晶體屬于離子晶體 B、晶體的化學式為Ba2O2
C、該晶體晶胞結構與CsCl相似 D、與每個Ba2+距離相等且最近的Ba2+共有8個
² 元素周期表 元素周期律 (①元素周期表中各主族元素的性質及其遞變規律;②原子核外電子排布規律)
1.食物中碲的一個來源是裝食物的含錫罐頭。通常開罐時約有8毫克金屬屑落入食物中,其中含碲0.1%(即8微克)。因此,用塑料包裝代替罐頭可以防止攝入碲,碲具有內在的毒性,碲可能會包含在酶體系中,與蛋白配合,引起腎和肝退化。碲在元素周期表中的位置是
A.第四周期IVA族 B.第五周期IVA族 C.第四周期VIA族 D.第五周期VIA族
2.X、Y、Z 3種元素。已知:X+ 和Y-兩種離子具有相同的電子層結構;Z元素原子核內質子數比Y元素原子核內質子數少9個,Y和Z兩元素可以形成42個電子的負一價陰離子。下列有關說法正確的是
A、離子半徑:X+>Y- B、原子序數X>Y>Z
C、X、Y、Z均屬于短周期元素 D、X、Y、Z可以形成XYZ、XYZ3、XYZ4等化合物
 3.右表為元素周期表前四周期的一部分,下列有關R、W、X、Y、Z五種元素的敘述中,正確的是
3.右表為元素周期表前四周期的一部分,下列有關R、W、X、Y、Z五種元素的敘述中,正確的是
A.常壓下五種元素的單質中Z單質的沸點最高
B.Y、Z的陰離子電子層結構都與R原子的相同
C.Y元素的非金屬性比W元素的非金屬性強
D.W的氫化物沸點比X的氫化物的沸點高
4.鎵是1871年俄國化學家門捷列夫在編制元素周期表時曾預言的“類鋁”元素。鎵的原子序數為31,屬ⅢA族。鎵的熔點為
A.鎵是制造高溫溫度計的上佳材料 B. 鎵能溶于強酸和強堿中
C.鎵與鋅、錫、銦等金屬制成的合金,可用在自動救火的水龍頭中
D.近年來鎵成為電子工業的新寵,其主要用途是制造半導體材料,被譽為“半導體材料的新糧食”,這是利用了鎵的導電性介于導體和絕緣體之間的性質
² 有關阿伏加德羅常數的判斷和計算
1.設NA代表阿佛加德羅常數,下列說法錯誤的是
A.
C.
D.
2.NA代表阿伏加德羅常數值,下列說法正確的是
(A)
(B)1molMgCl2中含有離子數為NA
(C)
(D)1molC10H22分子中共價鍵總數為31NA
3.下列有關阿伏加德羅常數的敘述正確的是
(A)標準狀況下,以任意比混合的甲烷和丙烷混合氣體
(B)1mol冰醋酸中含有6.02×1023個CH3COO―
(C)電解飽和食鹽水時,每得到1molNaOH,在陽極反應的離子就得到1mol電子
(D)標準狀況下,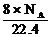
4.設NA為阿伏加德羅常數值,下列敘述中不正確的是
A.
B.
C.
D.2mol SO 2和1mo lO 2 混合在V2 O 5存在的條件下密閉容器中加熱反應后,容器內物質分子數大于2 NA
² 氧化還原反應(包括氧化還原反應基本概念;氧化性還原性強弱的判斷;根據得失電子守恒推斷氧化產物或還原產物;配平氧化還原反應的方程式并標出電子轉移的方向和數目)
1.羥胺(NH2OH)是一種還原劑,能將某些氧化劑還原。現用25.00mL0.049mol/L的羥胺的酸性溶液跟足量的硫酸鐵溶液在煮沸條件下反應,生成的Fe2+恰好與24.65mL 0.020mol/L的KMnO4酸性溶液完全作用(已知:FeSO4+ KMnO4+ H2SO4= Fe2(SO4)3+ K2SO4+ MnSO4+ H2O(未配平)),則在上述反應中,羥胺的氧化產物是
(A)N2 (B)N2O (C)NO (D)NO2
2.被稱為萬能還原劑的NaBH4溶于水并和水反應:NaBH4+2H2O=NaBO2+4H2↑,下列說法中正確的是(NaBH4中H為-1價)
A.NaBH4既是氧化劑又是還原劑 B.NaBH4是氧化劑,H2O是還原劑
C.硼元素被氧化,氫元素被還原 D.被氧化的元素與被還原的元素質量比為1:1
3.將一定量的鋅與100mL 18.5mol/L濃硫酸充分反應后,鋅完全溶解,同時生成氣體A
A. 氣體A為SO2和H2的混合物 B. 氣體A中SO2與H2的體積比為4:1
C. 反應中共消耗Zn
4.銅既能與稀硝酸反應,也能與濃硝酸反應,當銅與一定濃度硝酸反應時,可將方程式表示為:Cu+HNO3=Cu(NO3)2+NO↑+NO2↑+H2O。
(1) 硝酸在該反應中的作用是 ,該反應的還原產物是 。
(2) 0.3mol Cu被硝酸完全溶解后,Cu失去的電子數是 ,如果得到的NO和NO2
物質的量相同,則參加反應的硝酸的物質的量是 ,若用排水法收集這些氣體,
可得標準狀況下的氣體體積 。
(3) 如果參加反應的Cu和HNO3的物質的量之比是3:10,寫出并配平該反應的離子方程式____________________________ _________________________________。
(4) 如果沒有對該反應中的某些物質的比例作限定,則方程式可能的配平系數有許多組。
原因是_______________ ______________________。
² 熱化學方程式的書寫及正誤判斷;有關熱化學方程式的簡單計算
1.在101kPa和
H2(g)+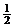 O2(g)=H2O(g);ΔH
= -241.8kJ/mol H2(g)+
O2(g)=H2O(g);ΔH
= -241.8kJ/mol H2(g)+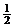 O2(g)=H2O(l);ΔH
= -285.8kJ/mol 下列說法中錯誤的是
O2(g)=H2O(l);ΔH
= -285.8kJ/mol 下列說法中錯誤的是
A.H2燃燒生成1mol H2O(g)時,放出241.8 kJ的熱量 B.H2的燃燒熱為285.8 kJ
C.O2前面的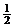 表示參加反應的O2的物質的量 D.1 mol水變成水蒸氣時吸收44kJ的熱量
表示參加反應的O2的物質的量 D.1 mol水變成水蒸氣時吸收44kJ的熱量
2.下列說法或表示方法正確的是
A.等質量的硫蒸氣和硫固體分別完全燃燒,后者放出的熱量多
B.由C(石墨)→C(金剛石);ΔH= +119 kJ/mol可知,金剛石比石墨穩定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);ΔH= -57.3 kJ/mol,若將含0.5mol H2SO4的濃硫酸與含1 mol NaOH的稀溶液混合,放出的熱量大于57.3 kJ
D.在101kPa、
3.已知充分燃燒a g乙炔氣體時生成1mol二氧化碳氣體和液態水,并放出熱量b kJ,則乙炔燃燒的熱化學方程式正確的是
A.
B.C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);ΔH= 2b kJ/mol
C.
D.
4.已知膽礬溶于水時溶液溫度降低。膽礬分解的熱化學方程式為:
CuSO4?5H2O(s) CuSO4(s)+5H2O(l);ΔH= +Q1 kJ/mol
CuSO4(s)+5H2O(l);ΔH= +Q1 kJ/mol
室溫下,若將1mol無水硫酸銅溶解為溶液時放熱Q2 kJ,則Q1與Q2的關系為
A.Q1>Q2
B.Q1=Q
² 離子方程式的書寫及正誤判斷
1、下列反應的離子方程式書寫正確的是
A.明礬溶液中加入過量的氨水 Al3++4OH-=AlO2-+2H2O
B.次氯酸鈣溶液中通入過量二氧化碳:ClO-+H2O+CO2=HClO+HCO3-
C. 用石墨作電極電解飽和食鹽水: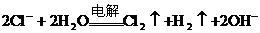
D.澄清的石灰水中加入少量的NaHCO3溶液:
Ca2++2OH-+2HCO3-=CaCO3↓+ 2H2O + CO32-
2.下列反應的離子方程式正確的是
(A)碳酸鈣跟醋酸溶液反應:CaCO3+2H+=Ca2++2H2O+CO2↑
(B)澄清石灰水跟鹽酸反應:H++OH― =H2O
(C)銅片跟稀硝酸反應:Cu+NO3―+4H+=Cu2++NO↑+2H2O
(D)碳酸氫鈉溶液與足量的氫氧化鋇溶液混合:
Ba2++2OH―+2HCO3―=BaCO3↓+CO32―+2H2O
3.下列離子方程式正確的是
A.等物質的量的Ba(OH)2與明礬溶液混合:
3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓
B.Fe(OH)3溶于氫碘酸:Fe(OH)3+3H+=Fe3++3H2O
C.H218O中投入Na2O2固體:2H218O+2O22-=4OH-+18O2↑
D.CuCl2溶液中加入NaHS溶液:Cu2++2HS-+2H2O=Cu(OH)2↓+2H2S↑
² 與量有關的離子方程式
1. FeBr2+Cl
1) 少量Cl2
2) 足量Cl2
2.明礬與氫氧化鋇溶液反應
1) 氫氧化鋇溶液不足
2) 氫氧化鋇溶液過量
3.Na2CO3+Ca(OH)2
1) Ca(OH)2不足
2) Ca(OH)2過量
4.NaAlO2+HCl
1) NaOH不足
2) NaOH過量
5.AlCl3+NaOH
1) NaOH不足
2) NaOH過量
² 判斷溶液中的離子能否大量共存
1.下列各組離子中,在堿性溶液能大量共存,且在加入鹽酸的過程中會產生氣體和沉淀的是
A Na+ 、 NO3- 、AlO- 、SO42- B Na+ 、NO3- 、SiO32- 、I-
C K+ 、Cl- 、AlO2- 、CO32- D Na+ 、Cl- 、HCO3- 、Ca2+
2.在下述條件下,一定能大量共存的離子組是
A.無色透明的水溶液中:K+、Mg2+、I-、MnO4-
B.pH=1的NaNO3水溶液中:NH4+、Fe2+、SO42-、Cl-
C.c(HCO3-)=0.1mol/L的溶液中:Na+、K+、CO32-、Br-
D.由水電離產生的c(OH-)=1×10-14mol/L的溶液中:H+、Al3+、Cl-、NO3-
3.常溫下,某溶液中由水電離產生的c(H+)、C(OH-)滿足c(H+)?c(OH+)=10-24,則下各
離子在該溶液中一定可以大量共存的是
A.K+ Na+ AlO2- Cl- B.Na+ Cl- SO42- HCO3-
C.NH4+ Na+ NO3- SO42- D.Ba2+ Na+ Cl- NO3-
² 溶解度、 物質的量、摩爾質量、粒子數、密度等的判斷與計算
1.下列有關溶液性質的敘述,正確的是
A.室溫時飽和的二氧化碳水溶液,冷卻到
B.
C.強電解質在水中溶解度一定大于弱電解質
D.相同溫度下,把水面上的空氣換成相同壓力的純氧,
2.硝酸鉀在不同溫度時的溶解度如下表:
溫度(℃)
10
20
30
40
50
60
70
溶解度(g)
20.9
31.6
45.8
63.9
85.5
110.0
138.0
現有
3.在一定溫度下,物質M的溶解度為A克。向(100+A)克物質M的飽和溶液中加入A克M,析出帶一定結晶水的晶體B克,現取出B克結晶水合物加水配成相同溫度下的飽和溶液,需加水的質量為
(A)
² 化學反應速率與化學平衡(包括以下重要考點①平均反應速率的計算;②外因對化學反應速率及化學平衡的影響;③化學平衡狀態的標志;④相同平衡狀態的建立;⑤化學平衡移動圖象的處理;⑥有關化學平衡的簡單計算。)
 1.在體積、溫度都相同的條件下有如下反應:
1.在體積、溫度都相同的條件下有如下反應:
(A)Ⅰ、Ⅱ兩途徑最終達到平衡時,體系內混合氣體的百分組成相同
(B)Ⅰ、Ⅱ兩途徑最終達到平衡時,體系內混合氣體的百分組成不同
(C)達到平衡時,Ⅰ途徑的反應速率vA等于Ⅱ途徑的反應速率vD
(D)達到平衡時,Ⅰ途徑所得混合氣體的密度為Ⅱ途徑所得混合氣體密度的1/2
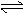 2.右圖表示可逆反應A(g)+B(g) nC(g) ΔH<0,在不同條件下反應混合物中C的百分含量和反應過程所需時間的關系曲線,有關敘述一定正確的是
2.右圖表示可逆反應A(g)+B(g) nC(g) ΔH<0,在不同條件下反應混合物中C的百分含量和反應過程所需時間的關系曲線,有關敘述一定正確的是
(A)a表示有催化劑,而b無催化劑
(B)若其他條件相同,a比b的溫度高
(C)若其他條件相同,a比b的壓強大,n>2
(D)反應由逆反應方向開始
 3.在一恒定的容器中充入2
mol A和1 mol B發生反應:
3.在一恒定的容器中充入2
mol A和1 mol B發生反應:
A.只能為2 B.只能為
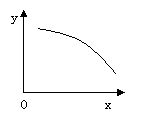 4.在一定條件下,固定容積的密閉容器中反應:2NO2(g)
4.在一定條件下,固定容積的密閉容器中反應:2NO2(g) ? O2(g) +
2NO(g);ΔH>0, 達到平穩。當改變其中一個條件X,Y隨X的變化符合圖中曲線的是
? O2(g) +
2NO(g);ΔH>0, 達到平穩。當改變其中一個條件X,Y隨X的變化符合圖中曲線的是
A、當X表示溫度時,Y表示NO2的物質的量
B、當X表示壓強時,Y表示NO2的轉化率
C、當X表示反應時間時,Y表示混合氣體的密度
D、當X表示NO2的物質的量時,Y表示O2的物質的量
 5.在
5.在
壓強/ Pa
200KPa
500KPa
1000KPa
D的濃度/mol?L-1
0.085
0.20
0.44
根據表中數據,回答下列問題:
(1)壓強從200KPa增大到500KPa時,平衡向 反應方向移動(填“正”或“逆”),其理由是 。
(2)壓強從500KPa增加到1000KPa,平衡向 反應方向移動(填“正”或“逆”),其理由是 。平衡之所以向該方向移動,這是由于 。
6. 2007年諾貝爾化學獎授予德國科學家格哈德?埃特爾,以表彰他在表面化學研究領域作出的開拓性貢獻。表面化學領域的研究可以幫助我們了解眾多紛雜的化學過程,如鋼鐵為何會生銹,燃料電池如何作用以及某些反應的催化劑是如何發揮其功能的,甚至可以解釋臭氧層的消耗現象等。
⑴某校化學研究性學習小組的同學在技術人員的指導下,按下列流程探究不同催化劑對NH3還原NO反應的催化性能。
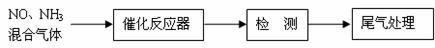
若控制其他實驗條件均相同,在催化反應器中裝載不同的催化劑,將經催化反應后的混合氣體通過滴有酚酞的稀硫酸溶液(溶液的體積、濃度均相同)。為比較不同催化劑的催化性能,需要測量并記錄的數據是 。
⑵在汽車的排氣管上安裝“催化轉化器”(用鉑、鈀合金作催化劑),它的作用是使CO、NO反應生成可參與大氣生態環境循環的無毒氣體,并促使烴類充分燃燒。
寫出CO與NO反應的化學方程式: ,
該反應作氧化劑的物質是___ ______。
⑶①有人認為:該研究可以使氨的合成反應,在鐵催化劑表面進行時的效率大大提高,從而使原料的轉化率大大提高。請你應用化學基本理論對此觀點進行評價:
|