金屬單質及其化合物
 2、鎂及其化合物
2、鎂及其化合物
 3、鋁及其化合物
3、鋁及其化合物
 4、鐵、銅及其化合物
4、鐵、銅及其化合物
知識梳理
一、鈉及其化合物
1、鈉
 (1)鈉的物理性質:鈉是銀白色金屬,密度小(0.97g/cm3),熔點低(97℃),硬度小,質軟,可用刀切割。鈉通常保存在煤油中。是電和熱的良導體。
(1)鈉的物理性質:鈉是銀白色金屬,密度小(0.97g/cm3),熔點低(97℃),硬度小,質軟,可用刀切割。鈉通常保存在煤油中。是電和熱的良導體。
(2)鈉的化學性質:從原子結構可知鈉是活潑的金屬單質。
①鈉與非金屬單質反應:常溫:4Na
+ O2 ==
2Na2O,加熱:2Na
+ O2  Na2O2;
Na2O2;
2Na + Cl2
 2NaCl; 2Na + S
2NaCl; 2Na + S  Na2S等。
Na2S等。
②鈉與水反應:2Na
+ 2H2O ==
2NaOH + H2↑;實驗現象:鈉浮在水面上,熔成小球,
在水面上游動,有哧哧的聲音,最后消失,在反應后的溶液中滴加酚酞,溶液變紅。
注意:鈉在空氣中的變化:銀白色的鈉 變暗(生成了氧化鈉)
變暗(生成了氧化鈉) 變白(生成氫氧化鈉)
變白(生成氫氧化鈉) 潮解
潮解 變成白色固體(生成碳酸鈉)。
變成白色固體(生成碳酸鈉)。
③鈉與酸反應:如2Na
+ 2HCl ==
2NaCl + H2↑,Na放入稀鹽酸中,是先與酸反應,酸不足再與水反應。因此Na放入到酸溶液中Na是不可能過量的。同時Na與H2的物質的量比始終是2:1。當然反應要比鈉與水的反應劇烈多。
④鈉與鹽的溶液反應:鈉不能置換出溶液中的金屬,鈉是直接與水反應。反應后的堿再與溶液中的其他物質反應。如鈉投入到硫酸銅溶液的反應式:2Na
+ CuSO4 + 2H2O ==
Cu(OH)2 ↓+ Na2SO4 + H2 ↑。
⑤鈉與氫氣的反應:2Na
+ H2 ==
2NaH。NaH + H2O
== NaOH + H2
↑;NaH是強的還原劑。
(3)工業制鈉:電解熔融的NaCl,2NaCl(熔融)  2Na + Cl2↑。
2Na + Cl2↑。
(4)鈉的用途:①在熔融的條件下鈉可以制取一些金屬,如鈦、鋯、鈮、鉭等;
②鈉鉀合金是快中子反應堆的熱交換劑;
③鈉蒸氣可作高壓鈉燈,發出黃光,射程遠,透霧能力強。
2、氧化鈉和過氧化鈉
(1)Na2O:白色固體,是堿性氧化物,具有堿性氧化物的通性:Na2O
+ H2O ==
2NaOH,
Na2O + CO2 == Na2CO3,Na2O
+ 2HCl ==
2NaCl + H2O .另外:加熱時,2Na2O + O2 == 2Na2O2.
(2)Na2O2:淡黃色固體是復雜氧化物,易與水、二氧化碳反應放出氧氣。
2Na2O2 + 2H2O == 4NaOH + O2
↑,2Na2O2 + 2CO2 == 2Na2CO3
+ O2 ↑(作供氧劑)。
因此Na2O2常做生氧劑,同時,Na2O2還具有強氧化性,有漂白作用。如實驗:Na2O2和水反應后的溶液中滴加酚酞,變紅后又褪色,實驗研究表明是有:Na2O2
+ H2O ==
2NaOH + H2O2,2H2O2 == 2H2O
+ O2 反應發生。因為H2O2也具有漂白作用。當然過氧化鈉也可以直接漂白的。
3、碳酸鈉和碳酸氫鈉
性質
Na2CO3(Na2CO3?10H2O)
NaHCO3
性質比較
俗稱
純堿或蘇打
小蘇打
NaHCO3的顆粒比Na2CO3小
水溶性
易溶于水
易溶于水
S(Na2CO3)>S(NaHCO3)
溶液酸堿性
顯堿性
顯堿性
同濃度Na2CO3溶液的pH大于NaHCO3溶液的pH
熱穩定性
穩定
受熱分解生成Na2CO3、H2O、CO2
NaHCO3的熱穩定性比Na2CO3差,用于除雜質。
與酸反應
能與強酸反應
能與強酸反應
等物質的量時Na2CO3耗酸量大于NaHCO3
溶液中相互轉化
Na2CO3溶液能吸收CO2轉化為NaHCO3
Na2CO3
+ H2O + CO2 ==
2 NaHCO3
除CO2中的HCl雜質是用飽和的NaHCO3溶液,而不用Na2CO3溶液
用途
用在玻璃、肥皂、合成洗滌劑、造紙、紡織、石油、冶金等工業中。
發酵粉的主要成分之一;制胃酸過多等。
注意幾個實驗的問題:
1、向飽和的Na2CO3溶液中通足量的CO2有晶體NaHCO3析出。
2、Na2CO3溶液與稀HCl的反應①向Na2CO3溶液中滴加稀HCl,先無氣體,后有氣體,如果n(HCl)小于n(Na2CO3)時反應無氣體放出。發生的反應:先①Na2CO3
+ HCl ==
NaCl + NaHCO3,后②NaHCO3 + HCl == NaCl + H2O +CO2
.
②向稀HCl中滴加Na2CO3溶液,先有氣體,反應是:Na2CO3
+ 2HCl ==
2NaCl + H2O + CO2.
如果用2mol的Na2CO3和2.4mol的稀HCl反應,采用①方法放出CO2是0.4mol;采用②方法放出CO2為1.2mol。希望同學們在解題時要留意。
3、Na2CO3溶液和NaHCO3溶液的鑒別:取兩種試液少量,分別滴加CaCl2或BaCl2溶液,有白色沉淀的原取溶液為Na2CO3,另一無明顯現象的原取溶液為NaHCO3。
4、侯氏制堿法
反應式:NaCl
+ NH3 + CO2 + H2O == NaHCO3 ↓+ NH4Cl.
注意:在生產中應先在飽和的NaCl溶液中先通入NH3,后通入CO2,NaHCO3晶體析出過濾,在濾液中加入NaCl細末和通NH3析出NH4Cl晶體為副產品。NH4Cl晶體析出后的母液進行循環試用,提高原料的利用率。
二、鎂及其化合物
1、鎂的性質
(1)物理性質:鎂是銀白色金屬,質較軟,密度1.74g/cm3,是輕金屬,硬度小。
(2)化學性質:鎂是較活潑金屬
①與非金屬反應:2Mg
+ O2 ==
2MgO,Mg + Cl2  MgCl2,3Mg + N2
MgCl2,3Mg + N2  Mg3N2等。
Mg3N2等。
②與沸水反應:Mg +
2H2O(沸水)== Mg(OH)2
+ H2 ↑.
③與酸反應:與非強氧化性酸反應:是酸中的H+與Mg反應,有H2放出。
與強氧化性酸反應:如濃H2SO4、HNO3,反應比較復雜,但是沒有H2放出。
④與某些鹽溶液反應:如CuSO4溶液、FeCl2溶液、FeCl3溶液等。
Mg + 2FeCl3
== 2FeCl2
+ MgCl2, Mg + FeCl2
== Fe +
MgCl2.
2、鎂的提取:海水中含有大量的MgCl2,因此,工業上主要是從分離了NaCl的海水中來提取MgCl2.
流程:海水中加入CaO或Ca(OH)2 Mg(OH)2沉淀、過濾、洗滌沉淀,用稀HCl溶解
Mg(OH)2沉淀、過濾、洗滌沉淀,用稀HCl溶解 MgCl2溶液,蒸發結晶
MgCl2溶液,蒸發結晶 MgCl2?6H2O晶體,在HCl氣體環境中加熱
MgCl2?6H2O晶體,在HCl氣體環境中加熱 MgCl2固體,電解熔融的MgCl2
MgCl2固體,電解熔融的MgCl2 Mg + Cl2 ↑。
Mg + Cl2 ↑。
主要反應:MgCl2
+ Ca(OH)2 ==
Mg(OH)2↓+ CaCl2, Mg(OH)2 + 2HCl == MgCl2
+ 2H2O,
MgCl2?6H2O  MgCl2 + 6H2O , MgCl2(熔融)
MgCl2 + 6H2O , MgCl2(熔融)  Mg + Cl2↑。
Mg + Cl2↑。
3、鎂的用途:鎂主要是廣泛用于制造合金。制造的合金硬度和強度都較大。因此鎂合金被大量用火箭、導彈、飛機等制造業中。
4、氧化鎂(MgO):白色固體,熔點高(2800℃),是優質的耐高溫材料(耐火材料)。是堿性氧化物。
MgO + H2O == Mg(OH)2, MgO + 2HCl == MgCl2 + H2O 。
注意以下幾種情況的離子方程式的書寫:
(1)n(Mg(HCO3)2):n(NaOH)=1:4:Mg2+
+ 2HCO3- + 4OH- == Mg(OH)2↓+
2CO32- + 2H2O;
(2)n(Mg(HCO3)2):n(NaOH)=1:2:Mg2+
+ 2HCO3- + 2OH- == MgCO3↓+ CO32-
+ 2H2O;
(3)n(Mg(HCO3)2):N(NaOH)=1:1: Mg2+ + HCO3- + OH-
== MgCO3↓+H2O 。
三、鋁及其化合物
1、鋁的性質:
(1)物理性質:銀白色金屬,質較軟,但比鎂要硬,熔點比鎂高。有良好的導電、導熱性和延展性。
(2)化學性質:鋁是較活潑的金屬。
①通常與氧氣易反應,生成致密的氧化物起保護作用。4Al
+ 3O2 ==
2Al2O3。同時也容易與Cl2、S等非金屬單質反應。
②與酸反應:強氧化性酸,如濃硫酸和濃硝酸在常溫下,使鋁發生鈍化現象;加熱時,能反應,但無氫氣放出;非強氧化性酸反應時放出氫氣。
③與強堿溶液反應:2Al
+ 2NaOH + 2H2O ==
2NaAlO2 + 3H2↑。
④與某些鹽溶液反應:如能置換出CuSO4、AgNO3等溶液中的金屬。
⑤鋁熱反應:2Al
+ Fe2O3  Al2O3 + 2Fe。該反應放熱大,能使置換出的鐵成液態,適用性強。在實驗室中演示時要加入引燃劑,如濃硫酸和蔗糖或鎂條和氯酸鉀等。
Al2O3 + 2Fe。該反應放熱大,能使置換出的鐵成液態,適用性強。在實驗室中演示時要加入引燃劑,如濃硫酸和蔗糖或鎂條和氯酸鉀等。
2、氧化鋁(Al2O3):白色固體,熔點高(2054℃),沸點2980℃,常作為耐火材料;是兩性氧化物。我們常見到的寶石的主要成分是氧化鋁。有各種不同顏色的原因是在寶石中含有一些金屬氧化物的表現。如紅寶石因含有少量的鉻元素而顯紅色,藍寶石因含有少量的鐵和鈦元素而顯藍色。工業生產中的礦石剛玉主要成分是α-氧化鋁,硬度僅次于金剛石,用途廣泛。
兩性氧化物:既能與強酸反應又能與強堿反應生成鹽和水的氧化物。
Al2O3
+ 6HCl == 2AlCl3 + 3H2O ,Al2O3
+ 2NaOH == 2NaAlO2 + H2O 。
Al2O3是工業冶煉鋁的原料,由于氧化鋁的熔點高,電解時,難熔化,因此鋁的冶煉直到1886年美國科學家霍爾發現在氧化鋁中加入冰晶石(Na3AlF6),使氧化鋁的熔點降至1000度左右,鋁的冶煉才快速發展起來,鋁及其合金才被廣泛的應用。2Al2O3
 4Al + 3O2↑。
4Al + 3O2↑。
3、氫氧化鋁(Al(OH)3):白色難溶于水的膠狀沉淀,是兩性氫氧化物。熱易分解。
兩性氫氧化物:既能與強酸又能與強堿反應生成鹽和水的氫氧化物。
Al(OH)3 +
3HCl == AlCl3 + 3H2O, Al(OH)3 + NaOH == NaAlO2 + 2H2O.2Al(OH)3  Al2O3
+3 H2O
Al2O3
+3 H2O
4、鋁的冶煉:鋁是地殼中含量最多的金屬元素,自然界中主要是以氧化鋁的形式存在。工業生產的流程:鋁土礦(主要成分是氧化鋁) 用氫氧化鈉溶解過濾
用氫氧化鈉溶解過濾 向濾液中通入二氧化碳酸化,過濾
向濾液中通入二氧化碳酸化,過濾 氫氧化鋁
氫氧化鋁 氧化鋁
氧化鋁 鋁。
鋁。
主要反應:Al2O3
+ 2NaOH ==
2NaAlO2 + H2O ,CO2 + 3H2O + 2NaAlO2
== 2Al(OH)3↓+ Na2CO3
,2Al(OH)3
 Al2O3 +3 H2O
,2Al2O3
Al2O3 +3 H2O
,2Al2O3  4Al + 3O2↑。
4Al + 3O2↑。
5、鋁的用途:鋁有良好的導電、導熱性和延展性,主要用于導線、炊具等,鋁的最大用途是制合金,鋁合金強度高,密度小,易成型,有較好的耐腐蝕性。迅速風靡建筑業。也是飛機制造業的主要原料。
6、明礬的凈水:化學式:KAl(SO4)2?12H2O,它在水中能電離:KAl(SO4)2
== K+
+ Al3+ + 2SO42-。鋁離子與水反應,生成氫氧化鋁膠體,具有很強的吸附能力,吸附水中的懸浮物,使之沉降已達凈水目的。Al3+
+ 3H2O ==
Al(OH)3 (膠體)+
3H+ 。
知識整理:
①(Al(OH)3)的制備:在氯化鋁溶液中加足量氨水。AlCl3 + 3NH3?H2O == Al(OH)3↓+ 3NH4Cl 。
②實驗:A、向氯化鋁溶液中滴加氫氧化鈉溶液,現象是先有沉淀,后溶解。
反應式:先Al3+ + 3OH- == Al(OH)3↓, 后Al3+
+ 4OH- ==
AlO2- + 2H2O。
B、向氫氧化鈉溶液中滴加氯化鋁溶液,現象是開始無沉淀,后來有沉淀,且不溶解。
反應式:先Al3+ + 4OH- == AlO2-
+ 2H2O,后Al3+
+ 3AlO2- + 6H2O == 4Al(OH)3↓。
③實驗:向偏鋁酸鈉溶液中通二氧化碳,有沉淀出現。CO2 + 3H2O + 2NaAlO2 == 2Al(OH)3↓+ Na2CO3。
④將氯化鋁溶液和偏鋁酸鈉溶液混和有沉淀出現。 Al3+ + 3AlO2- + 6H2O
== 4Al(OH)3↓。
⑤實驗:A、向偏鋁酸鈉溶液中滴加稀鹽酸,先有沉定,后溶解。
反應的離子方程式:AlO2- + H+ + H2O == Al(OH)3
,Al(OH)3 + 3H+ ==
Al3+ + 2H2O 。
B、向稀鹽酸中滴加偏鋁酸鈉溶液,先無沉淀,后有沉淀且不溶解。
反應的離子方程式:AlO2- + 4H+ == Al3+ + 2H2O
,3AlO2- + Al3+ + 6H2O == 4Al(OH)3↓。


 ⑥鋁三角:
⑥鋁三角:
上圖中的每根箭頭都有一個反應,請同學們試著寫好。
四、鐵、銅及其化合物
1、鐵的性質:(1)物理性質:鐵是一種可以被磁鐵吸引的銀白色金屬,純鐵的熔點較高(1535℃),防腐能力強。密度7.83g/cm3,是電和熱的良導體。但是通常煉制的鐵中含有碳等雜質,使鐵的熔點降低,防腐能力大大下降。
(2)化學性質:鐵是活潑的金屬,在自然界中只有化合態形式,如磁鐵礦(Fe3O4),赤鐵礦(Fe2O3)等。
試題詳情
①與非金屬單質反應:3Fe
+ 2O2 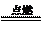 Fe3O4(Fe2O3?FeO),2Fe + 3Cl2
Fe3O4(Fe2O3?FeO),2Fe + 3Cl2
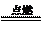 2FeCl3,
2FeCl3,
試題詳情
試題詳情
②高溫與水蒸氣反應:3Fe +
4H2O(g) 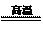 Fe3O4 + 4H2↑。
Fe3O4 + 4H2↑。
③與酸反應:強氧化性酸:常溫下濃硫酸和濃硝酸使鐵鈍化。加熱時,與強氧化性反應,但無氫氣放出。
非強氧化性酸:鐵與酸反應有氫氣放出。
④與某些鹽反應:如Fe +
CuSO4 ==
Cu + FeSO4 ,Fe +2 FeCl3 ==
3FeCl2等。
試題詳情
2、鐵的氧化物
FeO
Fe2O3
Fe3O4(Fe2O3?FeO)
鐵元素的價態
+2
+3
試題詳情
+2、+3
俗稱
鐵紅
磁性氧化鐵
色態
黑色粉末
紅棕色粉末
黑色晶體
類別
堿性氧化物
堿性氧化物
復雜氧化物
水溶性
難溶
難溶
難溶
穩定性
不穩定
穩定
穩定
主要化學性質
有一定的還原性易被氧化為三價鐵的化合物
與酸反應生成三價鐵鹽
化合物中+2的鐵有還原性,易被氧化。
試題詳情
3、鐵的氫氧化物
Fe(OH)2
Fe(OH)3
主要性質
白色難溶于水的沉淀,不穩定,易被氧化成氫氧化鐵,顏色變化為:白色-灰綠色-紅褐色。反應式:4Fe(OH)2
+ O2 + 2H2O ==
4Fe(OH)3。因此在制備時常采取措施:除溶液中的氧;加有機溶劑封住液面;膠頭滴管要伸入到溶液中。
試題詳情
紅褐色難溶于水的沉淀,受熱易分解。2Fe(OH)3  Fe2O3 + 3H2O
,能溶于強酸溶液,生成相應的鹽。
Fe2O3 + 3H2O
,能溶于強酸溶液,生成相應的鹽。
試題詳情
4、Fe2+、Fe3+的檢驗:
離子
Fe2+
Fe3+
常見方法
①滴加KSCN溶液,無明顯變化,再加氯水,溶液變血紅色;
②直接觀察溶液是淺綠色;
③滴加氫氧化鈉溶液,出現沉淀的顏色變化是:白色-灰綠色-紅褐色。
①直接觀察溶液是黃色;
②滴加氫氧化鈉溶液,出現紅褐色沉淀;③滴加KSCN溶液,有血紅色溶液出現。
試題詳情
5、鐵三角:
|
試題詳情
試題詳情
 ③:鐵與強氧化劑反應如Cl2、Br2、濃H2SO4
、濃HNO3等。
①
④ ③:鐵與強氧化劑反應如Cl2、Br2、濃H2SO4
、濃HNO3等。
①
④
④:用還原劑如H2
、CO等還原Fe2O3或用足量Mg、Zn、Al等還原 ② ③
| |
