
【題目】請用下列6種物質的序號填空:
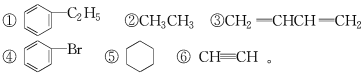
(1)屬于芳香烴的是__________;
(2)屬于鹵代烴的是__________;
(3)屬于鏈狀飽和烴是__________;
(4)含有碳碳雙鍵的是__________;
科目:高中化學 來源: 題型:
【題目】氨甲環酸(G)別名止血環酸,是一種已被廣泛使用半個世紀的止血藥,它的一種合成路線如下(部分反應條件和試劑略):
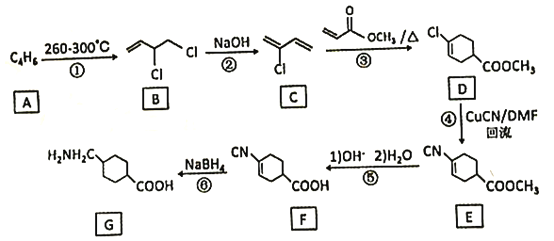
回答下列問題:
(1)A的結構簡式是____。C的化學名稱是_______。
(2)G在NaOH催化下發生雙分子脫水形成僅含兩個環的有機物,寫出該反應的化學反應方程式____。
(3)①~⑥中屬于取代反應的是_________。
(4)E中不含N原子的官能團名稱為___________。
(5)氨甲環酸(G)的分子式為__________。
(6)滿足以下條件的所有E的同分異構體有_____種。
a.含苯環 b.含硝基 c.苯環上只有兩個取代基
(7)寫出以![]() 和CH2=CHCOOCH2CH3為原料,制備
和CH2=CHCOOCH2CH3為原料,制備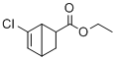 的合成路線:_______(無機試劑任性)
的合成路線:_______(無機試劑任性)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有關水的電離平衡的說法正確的是( )
A.水的離子積通常用![]() 來表示,只適用于純水,在稀鹽酸中數值會變大
來表示,只適用于純水,在稀鹽酸中數值會變大
B.在純水中加入硫酸會抑制水的電離,加醋酸會促進水的電離
C.鹽溶于水對水的電離平衡均沒有影響,水溶液一定呈中性
D.在純水中加入氫氧化鐵固體對水的電離平衡會有微弱的影響
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】磷酸氯喹(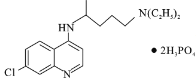 )是抑制新型冠狀病毒的“有效藥物”。磷酸氯喹可由氯喹(
)是抑制新型冠狀病毒的“有效藥物”。磷酸氯喹可由氯喹( )和磷酸在一定條件下制得。氯喹的合成路線如下:
)和磷酸在一定條件下制得。氯喹的合成路線如下:

(1)有機物A的名稱是___________,E中含氧官能團的名稱是___________。
(2)反應①、②的反應類型分別是___________、___________。
(3)寫出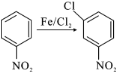 的方程式_______________。
的方程式_______________。
(4)F的結構簡式是___________。
(5)反應③的另一種產物為___________。
(6)M是H的一種同分異構體,寫出滿足下列條件的M的結構簡式(不考慮立體異構,只需寫出2種)____________________。
①分子結構中含有苯環(無其他環),且苯環上有三個取代基;
②能使溴水褪色;
③核磁共振氫譜有4組峰,峰面積之比為2:1:1:1。
(7)設計由甲苯為起始原料制備 的合成路線(無機試劑任選)___________。
的合成路線(無機試劑任選)___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于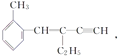 ,下列結論正確的是( )
,下列結論正確的是( )
A. 該有機物分子式為C13H16 B. 該有機物屬于苯的同系物
C. 該有機物分子至少有4個碳原子共直線 D. 該有機物分子最多有13個碳原子共平面
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】H3AsO4水溶液中含砷的各物種的分布分數(平衡時某物種的濃度占各物種濃度之和的分數)與pH的關系如下圖所示(已知pKa=-lgKa),下列說法正確的是

A. H3AsO4溶液pKa2為4.5
B. NaH2AsO4溶液顯堿性
C. 常溫下,m點對應溶液中由水電離出的OH—濃度為10—11.5 mol/L
D. n點對應溶液中,離子濃度關系:c(HAsO42—)=c(H2AsO4—)>c( OH—) =c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室制備苯甲醇和苯甲酸的化學原理是
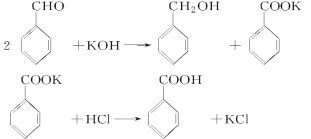
已知苯甲醛易被空氣氧化,苯甲醇的沸點為205.3 ℃;苯甲酸的熔點為121.7 ℃,沸點為249 ℃,溶解度為0.34 g;乙醚的沸點為34.8 ℃,難溶于水。制備苯甲醇和苯甲酸的主要過程如下所示:
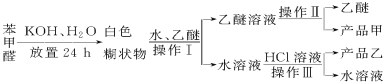
試根據上述信息回答下列問題:
(1)操作Ⅰ的名稱是________,乙醚溶液中所溶解的主要成分是________。
(2)操作Ⅱ的名稱是________,產品甲是________。
(3)操作Ⅲ的名稱是________,產品乙是________。
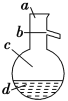
(4)如圖所示,操作Ⅱ中溫度計水銀球上沿放置的位置應是________(填“a”“b”“c”或“d”),該操作中,除需蒸餾燒瓶、溫度計外,還需要的玻璃儀器是__________________,收集產品甲的適宜溫度為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在容積為1 L的密閉容器中,加入5 mol A物質,在一定條件下同時發生下列兩個反應:
(1)2A(g) ![]() 2B(g)+C(g); (2)A(g)
2B(g)+C(g); (2)A(g) ![]() C(g)+D(g)。
C(g)+D(g)。
當達到平衡時,測得c(A)=2.5 mol·L-1(表示該物質濃度,下同),c(C)=2.0 mol·L-1。則下列說法中正確的是( )
A.達到平衡時A的總轉化率為40%B.達到平衡時c(B)為1.0 mol·L-1
C.達到平衡時c(B)=2c(D)D.達到平衡時c(D)=2c(B)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2016年11月4日是《巴黎協定》氣候協議生效的日期,其宗旨是提高綠色低碳轉型的競爭力、抵御氣候變化,人們需要用不同的方法將CO2進行轉化利用。
(1)處理CO2的方法之一是使其與氫氣反應合成甲醇。已知氫氣、甲醇燃燒的熱化學方程式如下:
2H2(g)+O2(g)=2H2O(1) △H=-283.0kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1) △H=-726.0kJ·mol-1
寫出二氧化碳與氫氣合成甲醇液體的熱化學方程式_________;
(2)CO2經催化加氫還可合成低碳烯烴:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) △H=QkJ·mol-1在0.1MPa時,按n(CO2):n(H2)=1:3投料,右圖表示平衡時四種氣態物質的物質的量(n)與溫度(T)的關系。
C2H4(g)+4H2O(g) △H=QkJ·mol-1在0.1MPa時,按n(CO2):n(H2)=1:3投料,右圖表示平衡時四種氣態物質的物質的量(n)與溫度(T)的關系。
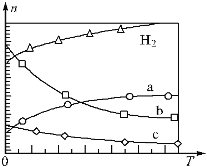
①Q______0(填“>”、“=”或“<”);
②曲線b表示的物質為_____。
(3)在強酸性的電解質水溶液中,用惰性材料做電極,電解CO2可得到多種燃料,其原理如右圖所示。

①該工藝中能量轉化方式主要有______;
②電解時,生成丙烯(C3H6)的電極反應式為______。
(4)以CO2為原料制取碳(C)的太陽能工藝如右圖所示。

①過程1中發生反應的化學方程式為______;
②過程2中每生成1molFe3O4[FeOFe2O3]轉移電子的物質的量為______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com