
【題目】含碳化合物種類繁多。回答下列問題:
(1)一定溫度下,在密閉容器中將等物質的量的CO(g)和H2O(g)混合,采用適當的催化劑進行反應CO(g)+H2O(g)![]() CO2(g)+H2(g),已知此溫度下,該反應的平衡常數K=16,則平衡時體系中H2的物質的量分數為_________%。
CO2(g)+H2(g),已知此溫度下,該反應的平衡常數K=16,則平衡時體系中H2的物質的量分數為_________%。
(2)在催化劑Ru催化下,CO2與H2反應可生成CH4,反應方程式為CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)。已知H2的體積分數隨溫度的升高而增加。若溫度從300℃升至400℃,重新達到平衡,則v正______(填“增大”“減小”或“不變”,下同),v逆_______,平衡常數K________,轉化率α________;若在相同溫度時,上述反應在不同起始濃度下分別達到平衡,各物質的平衡濃度如下表:
CH4(g)+2H2O(g)。已知H2的體積分數隨溫度的升高而增加。若溫度從300℃升至400℃,重新達到平衡,則v正______(填“增大”“減小”或“不變”,下同),v逆_______,平衡常數K________,轉化率α________;若在相同溫度時,上述反應在不同起始濃度下分別達到平衡,各物質的平衡濃度如下表:
c(CO2)/mol/L | c(H2)/mol/L | c(CH4)/mol/L | c(H2O)/mol/L | |
平衡I | a | b | c | d |
平衡II | m | n | x | y |
則a、b、c、d與m、n、x、y之間的關系式為_____________。
(3)已知相關物質的電離平衡常數如下表:

①0.1 mol·L-1的Na2CO3溶液的pH_______(填“大于”“小于”或“等于”)0.1 mol·L-1的Na2C2O4溶液的pH。
②若將等濃度的草酸溶液和碳酸溶液等體積混合,溶液中粒子濃度大小的順序正確的是_________(填字母)。
a.c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-) b.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
c.c(H+)>c(HC2O4-)>c(CO32-)>c(C2O42-) d.c(H2CO3)>c(HCO3-)>c(HC2O4-)>c(CO32-)
【答案】40 增大 增大 減小 減小 ![]() 大于 a
大于 a
【解析】
(1)假設反應開始時CO(g)和H2O(g)為1 mol,反應達到平衡時產生H2的物質的量為x,根據該溫度下平衡常數K=16計算x的值,再計算H2的平衡含量;
(2)溫度升高,化學反應速率加快;利用溫度升高,H2的含量增大判斷反應的熱效應,再分析溫度對平衡常數及物質平衡轉化率的影響;平衡常數的定義式書寫平衡常數,利用同一溫度下的平衡常數相同計算;
(3)根據鹽的水解規律分析、比較。
(1) 假設反應開始時CO(g)和H2O(g)為1 mol,反應達到平衡時產生H2的物質的量為x,根據反應CO(g)+H2O(g)![]() CO2(g)+H2(g)中物質轉化關系可知平衡時n(CO)=n(H2O)=(1-x) mol,n(CO2)=n(H2)=x mol,該反應是反應前后氣體體積相等的反應,所以根據平衡常數的含義可得K=
CO2(g)+H2(g)中物質轉化關系可知平衡時n(CO)=n(H2O)=(1-x) mol,n(CO2)=n(H2)=x mol,該反應是反應前后氣體體積相等的反應,所以根據平衡常數的含義可得K=![]() =16,解得x=0.8 mol,所以平衡時H2的體積分數為:
=16,解得x=0.8 mol,所以平衡時H2的體積分數為:![]() ×100%=40%;
×100%=40%;
(2)對于反應CO2(g)+4H2(g)![]() CH4(g)+2H2O(g),已知H2的體積分數隨溫度的升高而增加,說明升高溫度,化學平衡逆向移動。根據平衡移動原理:升高溫度,化學平衡向吸熱反應方向移動,所以該反應的正反應為放熱反應。若溫度從300℃升至400℃,溫度升高化學反應速率加快,所以重新達到平衡時v正增大,v逆增大,平衡逆向移動,使平衡常數K減小,反應物的轉化率α減小。若在相同溫度時,上述反應在不同起始濃度下分別達到平衡,根據各物質的平衡濃度可知平衡I的化學平衡常數K1=
CH4(g)+2H2O(g),已知H2的體積分數隨溫度的升高而增加,說明升高溫度,化學平衡逆向移動。根據平衡移動原理:升高溫度,化學平衡向吸熱反應方向移動,所以該反應的正反應為放熱反應。若溫度從300℃升至400℃,溫度升高化學反應速率加快,所以重新達到平衡時v正增大,v逆增大,平衡逆向移動,使平衡常數K減小,反應物的轉化率α減小。若在相同溫度時,上述反應在不同起始濃度下分別達到平衡,根據各物質的平衡濃度可知平衡I的化學平衡常數K1=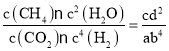 ,平衡II的化學平衡常數K2=
,平衡II的化學平衡常數K2=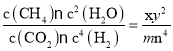 ,由于是該反應同一溫度下的平衡常數,所以K1= K2,所以
,由于是該反應同一溫度下的平衡常數,所以K1= K2,所以![]() ;
;
(3)①根據表格數據可知弱酸的電離平衡常數K2:H2C2O4>H2CO3,Na2CO3、Na2C2O4都是強堿弱酸鹽,水解使溶液顯堿性,由鹽的水解規律:誰弱誰水解,誰強顯誰性,越弱越水解,可知水解程度Na2CO3>Na2C2O4,所以兩種溶液的pH:Na2CO3>Na2C2O4;
②碳酸H2CO3:Ka1=4.3×10-7,Ka2=5.6×10-11,草酸H2C2O4:Ka1=5.9×10-2,Ka2=6.4×10-5,酸性:H2C2O4>H2CO3,根據酸電離平衡常數越大,該酸電離產生的離子濃度越大,溶液中H+是兩種酸電離產生,則H+濃度最大,由于酸電離分步進行,電離平衡常數減小,則該酸電離產生的離子濃度也逐漸減小,酸溶液中主要以酸分子存在,分子濃度大于電離產生的離子濃度,酸性強,則電離程度大,所以c(H2CO3)>c(H2C2O4),根據電離平衡常數的大小可以得到離子濃度大小順序是:c(H+)>c(HC2O4-)>c(HCO3-)>c(C2O42-)>c(CO32-),故合理選項是a。


 智趣寒假作業云南科技出版社系列答案
智趣寒假作業云南科技出版社系列答案科目:高中化學 來源: 題型:
【題目】模擬“人工樹葉”的電化學實驗裝置如圖所示,該裝置能將H2O和CO2轉化為O2和燃料(C3H8O)。下列說法正確的是
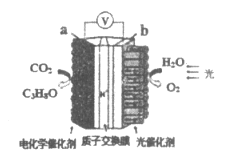
A.該裝置將化學能轉化為光能和電能
B.b電極上發生得e-的氧化反應
C.該裝置工作時,H+從b極區向a極區遷移
D.a電極上反應:3CO2+18H+-18e-=C3H8O+5H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家發現對冶金硅進行電解精煉提純可降低高純硅制備成本。相關電解裝置如圖所示,用Cu-Si合金作硅源,在950℃利用三層液熔鹽進行電解精煉,有關說法正確的是
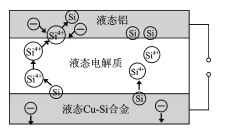
A.在該液相熔體中Cu優先于Si被氧化,Si4+優先于Cu2+被還原
B.液態Cu-Si合金作陽極,固體硅作陰極
C.電流強度的大小不會影響硅提純速率
D.三層液熔鹽的作用是增大電解反應接觸面積,提高硅沉積效率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO2是自然界碳循環中的重要物質。下列過程會引起大氣中CO2含量上升的是
A. 光合作用 B. 自然降雨
C. 化石燃料的燃燒 D. 碳酸鹽的沉積
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一體積固定的密閉容器中加入反應物N2、H2,發生反應:N2(g)+3H2(g)![]() 2NH3(g)。反應過程中的部分數據如表所示:
2NH3(g)。反應過程中的部分數據如表所示:

下列說法正確的是
A.0~2min內,H2的反應速率為0.1 mol/(L·min)
B.2min時,NH3的物質的量濃度為0.2 mol/L
C.4min時,反應已達到平衡狀態,此時正、逆反應的速率都為0
D.4~6min內,容器內氣體分子的總物質的量不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉬是一種過渡金屬元素,其單質通常用作合金及不銹鋼的添加劑,這種金屬可增強合金的強度、硬度、可焊性及韌性,還可增強其耐高溫及耐腐蝕性能。下圖是化工生產中制備金屬鉬的主要流程:

(1)用簡單氧化物形式表示![]() 的組成:____________________________。
的組成:____________________________。
(2)寫出反應①的化學方程式:______________________。
(3)反應①的尾氣可以再利用,寫出兩種利用該尾氣制得的化學藥品:______________________。
(4)工業上制備還原性氣體的反應原理有: ,
, 。將含甲烷體積分數為80%的a L(標準狀況下)天然氣與足量二氧化碳和水蒸氣混合物在高溫下反應,甲烷的轉化率為90%,用產生的還原性氣體(
。將含甲烷體積分數為80%的a L(標準狀況下)天然氣與足量二氧化碳和水蒸氣混合物在高溫下反應,甲烷的轉化率為90%,用產生的還原性氣體(![]() 和
和![]() )依據反應⑤冶煉鉬,理論上生成鉬的質量為___________(已知
)依據反應⑤冶煉鉬,理論上生成鉬的質量為___________(已知![]() 的相對原子質量為96)
的相對原子質量為96)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與生活密切相關。下列說法錯誤的是
A. PM2.5是指粒徑不大于2.5μm的可吸入懸浮顆粒物
B. 綠色化學要求從源頭上消除或減少生產活動對環境的污染
C. 燃煤中加入CaO可以減少酸雨的形成及溫室氣體的排放
D. 天然氣和液化石油氣是我國目前推廣使用的清潔燃料
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化錳不僅是活性好的催化劑,也被廣泛用作干電池的正極材料。某化學小組設計用高硫錳礦(主要成分為錳的化合物和硫化亞鐵)為原料制取二氧化錳的工藝流程如圖:
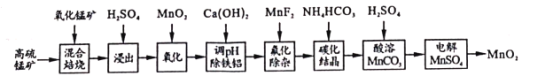
已知:①“混合焙燒”后的燒渣含MnSO4、Fe2O3及少量FeO、MgO、Al2O3
②在該條件下,金屬離子開始沉淀和完全沉淀的pH如表:
金屬離子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
開始沉淀 | 1.8 | 6.8 | 4.0 | 7.5 |
完全沉淀 | 3.2 | 8.0 | 5.0 | 8.4 |
(1)寫出浸出時與鋁元素有關的離子反應方程式____。
(2)上述“氧化”步驟是否可省略____(填“是”或“否”),你的依據是 _____。
(3)“調pH除鐵鋁’’時,生成沉淀的pH范圍為____;“氟化除雜”中除去的離子為____。
(4)請用平衡移動原理解釋除雜處理后的Mn2+用NH4HCO3轉化成MnCO3沉淀的過程___(用文字和離子方程式表達)。
(5)用惰性電極電解MnSO4制備MnO2時,其陽極反應式為____;整個流程中能夠循環利用的物質除MnO2外還有___(寫名稱)。
查看答案和解析>>
科目:高中化學 來源: 題型:
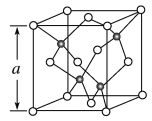
【題目】(1)Cu的一種氯化物晶胞結構如圖所示(黑球表示銅原子,白球表示氯原子),該氯化物的化學式是__。若該晶體的密度為ρg·cm-3,以NA表示阿伏加德羅常數的值,則該晶胞的邊長a=__nm。
(2)一種四方結構的超導化合物的晶胞如圖1所示,晶胞中Sm和As原子的投影位置如圖2所示。
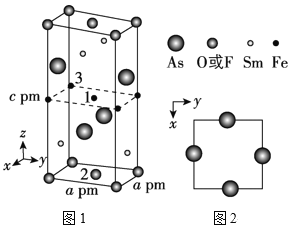
圖中F-和O2-共同占據晶胞的上下底面位置,若兩者的比例依次用x和1x代表,則該化合物的化學式表示為__,通過測定密度ρ和晶胞參數,可以計算該物質的x值,完成它們關系表達式:ρ=__g·cm-3。
以晶胞參數為單位長度建立的坐標系可以表示晶胞中各原子的位置,稱作原子分數坐標,例如圖1中原子1的坐標為(![]() ,
,![]() ,
,![]() ),則原子2和3的坐標分別為__、__。
),則原子2和3的坐標分別為__、__。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com