
【題目】二氧化錳不僅是活性好的催化劑,也被廣泛用作干電池的正極材料。某化學小組設計用高硫錳礦(主要成分為錳的化合物和硫化亞鐵)為原料制取二氧化錳的工藝流程如圖:
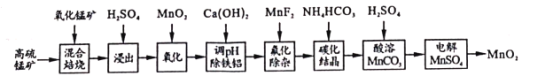
已知:①“混合焙燒”后的燒渣含MnSO4、Fe2O3及少量FeO、MgO、Al2O3
②在該條件下,金屬離子開始沉淀和完全沉淀的pH如表:
金屬離子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
開始沉淀 | 1.8 | 6.8 | 4.0 | 7.5 |
完全沉淀 | 3.2 | 8.0 | 5.0 | 8.4 |
(1)寫出浸出時與鋁元素有關的離子反應方程式____。
(2)上述“氧化”步驟是否可省略____(填“是”或“否”),你的依據是 _____。
(3)“調pH除鐵鋁’’時,生成沉淀的pH范圍為____;“氟化除雜”中除去的離子為____。
(4)請用平衡移動原理解釋除雜處理后的Mn2+用NH4HCO3轉化成MnCO3沉淀的過程___(用文字和離子方程式表達)。
(5)用惰性電極電解MnSO4制備MnO2時,其陽極反應式為____;整個流程中能夠循環利用的物質除MnO2外還有___(寫名稱)。
【答案】Al2O3+6H+=3H2O+2Al3+ 否 若不進行氧化,則Fe2+被完全沉淀的pH為8.0,此時Mn2+也會被部分沉淀,造成損失 5.0≤pH<7.5 Mg2+、Ca2+ 加入NH4HCO3后,Mn2+與HCO3-電離出的CO32-生成MnCO3,HCO3-H++ CO32-、Mn2++CO32-MnCO3,HCO3-電離出H+與另一部分HCO3-反應生成H2O和CO2,促進上述兩個平衡正向移動,從而生成MnCO3沉淀 Mn2+-2e-+2H2O=MnO2+4H+ 硫酸
【解析】
高硫錳礦(主要成分為含錳化合物及FeS)與氧化錳礦混合焙燒,得到MnSO4、Fe2O3及少量FeO、Al2O3、MgO,加入硫酸,得到Mn2+、Fe2+、Fe3+、Mg2+、Al3+的酸性溶液,加入二氧化錳將亞鐵離子氧化為鐵離子便于除去,再加入碳酸鈣中和,將鐵離子與鋁離子以氫氧化物的形式除去,加入MnF2除雜,使溶液中的Mg2+、Ca2+沉淀完全,此時溶液中的金屬離子為錳離子,加入碳酸氫銨發生Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,加入硫酸溶解碳酸錳得到硫酸錳溶液,經過電解得到二氧化錳,據此分析解答。
(1)浸出時Al2O3與硫酸反應生成硫酸鋁,與鋁元素有關的離子反應方程式為:Al2O3+6H+=3H2O+2Al3+;
(2)根據沉淀表格數據,若不進行氧化,則Fe2+被完全沉淀的pH為8.0,此時Mn2+也會被部分沉淀,造成損失,則上述“氧化”步驟不可省略;
(3)“調pH除鐵鋁’’時,根據數據,pH為5.0時鋁離子完全沉淀,pH為7.5時錳離子開始沉淀,則生成沉淀的pH范圍為5.0≤pH<7.5;根據分析,“氟化除雜”中加入MnF2除雜,使溶液中的Mg2+、Ca2+沉淀完全,除去的離子為Mg2+、Ca2+;
(4)加入NH4HCO3后,Mn2+與HCO3-電離出的CO32-生成MnCO3,HCO3-H++ CO32-、Mn2++CO32-MnCO3,HCO3-電離出H+與另一部分HCO3-反應生成H2O和CO2,促進上述兩個平衡正向移動,從而生成MnCO3沉淀;
(5)用惰性電極電解MnSO4制備MnO2時,其陽極發生氧化還原,化合價升高失電子,錳元素由+2價升高為+4價,失電子被氧化,則陽極反應式為Mn2+-2e-+2H2O=MnO2+4H+;硫酸根離子與氫離子結合生成硫酸,則整個流程中能夠循環利用的物質除MnO2外還有硫酸。


科目:高中化學 來源: 題型:
【題目】SO2的含量是衡最大氣污染的一個重要指標,工業上常采用催化還原法或吸收法處理SO2。利用催化還原SO2不僅可消除SO2污染,而且可得到有經濟價值的單質S。
(1)在復合組分催化劑作用下,CH4可使SO2轉化為S,同時生成CO2和H2O。
己知CH4和S的燃燒熱(△H)分別為-890.3k/mol和-297.2kJ/mol,則CH4和SO2反應的熱化學方程式為_____________。
(2)用H2還原SO2生成S的反應分兩步完成,如圖1所示,該過程中相關物質的物質的量濃度隨時間的變化關系如圖2所示:
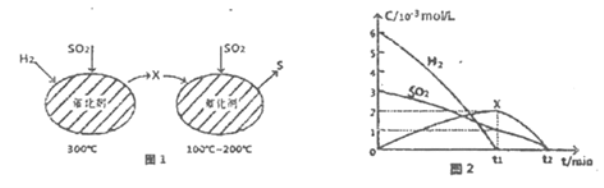
①分析可知X為______(寫化學式),0~t1時間段的溫度為_____,0~t1時間段用SOz表示的化學反應速率為________。
②總反應的化學方程式為_____________。
(3)焦炭催化還原SO2生成S2,化學方程式為:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,1mol/LSO2與足量的焦炭反應,SO2的轉化率隨溫度的變化如圖3所示。
S2(g)+2CO2(g),恒容容器中,1mol/LSO2與足量的焦炭反應,SO2的轉化率隨溫度的變化如圖3所示。

①該反應的△H____0(填“>”或“<”)
②算a點的平衡常數為_________。
(4)工業上可用Na2SO3溶液吸收法處理SO2,25℃時用1mo/L的Na2SO3溶液吸收SO2。當溶液pH=7時,溶液中各離子濃度的大小關系為________。已知:H2SO3的電離常數K1=1.3×10-2,K2=6.2×10-8
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】含碳化合物種類繁多。回答下列問題:
(1)一定溫度下,在密閉容器中將等物質的量的CO(g)和H2O(g)混合,采用適當的催化劑進行反應CO(g)+H2O(g)![]() CO2(g)+H2(g),已知此溫度下,該反應的平衡常數K=16,則平衡時體系中H2的物質的量分數為_________%。
CO2(g)+H2(g),已知此溫度下,該反應的平衡常數K=16,則平衡時體系中H2的物質的量分數為_________%。
(2)在催化劑Ru催化下,CO2與H2反應可生成CH4,反應方程式為CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)。已知H2的體積分數隨溫度的升高而增加。若溫度從300℃升至400℃,重新達到平衡,則v正______(填“增大”“減小”或“不變”,下同),v逆_______,平衡常數K________,轉化率α________;若在相同溫度時,上述反應在不同起始濃度下分別達到平衡,各物質的平衡濃度如下表:
CH4(g)+2H2O(g)。已知H2的體積分數隨溫度的升高而增加。若溫度從300℃升至400℃,重新達到平衡,則v正______(填“增大”“減小”或“不變”,下同),v逆_______,平衡常數K________,轉化率α________;若在相同溫度時,上述反應在不同起始濃度下分別達到平衡,各物質的平衡濃度如下表:
c(CO2)/mol/L | c(H2)/mol/L | c(CH4)/mol/L | c(H2O)/mol/L | |
平衡I | a | b | c | d |
平衡II | m | n | x | y |
則a、b、c、d與m、n、x、y之間的關系式為_____________。
(3)已知相關物質的電離平衡常數如下表:

①0.1 mol·L-1的Na2CO3溶液的pH_______(填“大于”“小于”或“等于”)0.1 mol·L-1的Na2C2O4溶液的pH。
②若將等濃度的草酸溶液和碳酸溶液等體積混合,溶液中粒子濃度大小的順序正確的是_________(填字母)。
a.c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-) b.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
c.c(H+)>c(HC2O4-)>c(CO32-)>c(C2O42-) d.c(H2CO3)>c(HCO3-)>c(HC2O4-)>c(CO32-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于晶體的說法正確的組合是( )
①分子晶體中都存在共價鍵
②在晶體中只要有陽離子就一定有陰離子
③金剛石、SiC、NaF、NaCl、H2O、H2S晶體的熔點依次降低
④離子晶體中只有離子鍵沒有共價鍵,分子晶體中肯定沒有離子鍵
⑤CaTiO3晶體中(晶胞結構如圖所示)每個鈦原子和12個氧原子緊相鄰

⑥SiO2晶體中每個硅原子與兩個氧原子以共價鍵相結合
⑦晶體中分子間作用力越大,分子越穩定
⑧氯化鈉熔化時離子鍵被破壞
A.①②③⑥B.①②④C.③⑤⑦D.③⑤⑧
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硝酸鈉廣泛用于媒染劑、漂白劑等。某興趣小組用下列裝置制取較純凈的NaNO2。
甲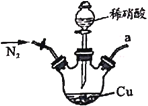 乙
乙 丙
丙 丁
丁![]()
反應原理為:2NO+Na2O2=2NaNO2。已知:NO能被酸性KMnO4氧化成NO3-,MnO4-被還原為Mn2+。下列分析錯誤的是
A.甲中滴入稀硝酸前需通人N2
B.儀器的連接順序為a-f-g-d-e-b
C.丙中CaCl2用于干燥NO
D.乙中吸收尾氣時發生的離子反應為3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設阿伏加德羅常數的值為NA,下列說法正確的是
A.25°C時,pH=13的氫氧化鋇溶液中含有OH-0.1NA個
B.電解精煉銅時,當電路中轉移NA個電子,陽極的質量一定減輕了32g
C.0.1 mol H2和0.1 mol I2于密閉容器中充分反應后,其分子總數為0.2NA
D.1 L 0.1 mol·L-1 NH4Cl溶液中,NH4+的數量為0.1NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關電化學原理的說法正確的是
A.用惰性電極電解MgCl2飽和溶液可制得金屬鎂
B.用惰性電極電解CuCl2溶液時,陽極表面生成紅色物質
C.在鐵釘表面電鍍銅時,將鐵釘作陽極,銅作陰極,硫酸銅溶液為電解質
D.用石墨電極電解飽和食鹽水的過程中,溶液的pH逐漸增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO是大氣污染氣體,可利用化學反應進行治理或轉化。
(1)甲醇是重要的溶劑和燃料,工業上用CO和H2在一定條件下制備CH3OH的反應為:CO(g)+2H2(g)![]() CH3OH(g) △H<0
CH3OH(g) △H<0
①T℃時,向容積為2L的恒容密閉容器中充入1 mol CO和1.2 mol H2,一段時間后達到平衡,此時H2與CH3OH的體積分數之比為2:5,該反應的平衡常數K=___________;此時若向容器中再通入0.4 mol CO和0.2 mol CH3OH(g),則平衡將___________移動。(填“向正反應方向”“不”或“向逆反應方向”)
②在一容積可變的密閉容器中充入一定物質的量的CO和H2,測得CO在不同溫度下的平衡轉化率與壓強的關系如圖所示。a、b、c三點平衡常數K(a)、K(b)、K(c)的大小關系是___________。b、d點的正反應速率vb(CO)_______va(CO).
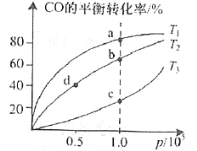
(2)瀝青混凝土可作為2CO(g)+O2(g)![]() 2CO2(g)反應的催化劑。圖表示在相同的恒容密閉容器、相同起始濃度、反應相同的時間,使用同質量的不同瀝青混凝土(α型、β型)催化時,CO的轉化率與溫度的關系。
2CO2(g)反應的催化劑。圖表示在相同的恒容密閉容器、相同起始濃度、反應相同的時間,使用同質量的不同瀝青混凝土(α型、β型)催化時,CO的轉化率與溫度的關系。
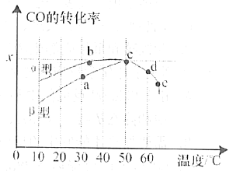
①a、b、c、d四點中表示平衡狀態的是___________;
②e點轉化率出現突變的原因可能是______________________。
(3)電解法轉化CO2可實現CO2資源化利用。電解時CO2在陰極區轉化為HCOOH,其原理示意圖如下:
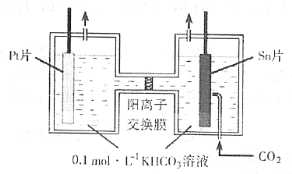
電解一段時間后,陽極區的KHCO3溶液濃度降低,其原因是_________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1,2-二氯丙烷(CH2ClCHClCH3)是一種重要的化工原料,工業上可用丙烯加成法制備,主要副產物為3-氯丙烯(CH2=CHCH2Cl),反應原理為:
I.CH2=CHCH3(g)+Cl2(g) ![]() CH2ClCHClCH3(g) H1=-134kJ·mol-1
CH2ClCHClCH3(g) H1=-134kJ·mol-1
II.CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g) H2=-102kJ·mol-1
請回答下列問題:
(1)已知CH2=CHCH2Cl(g)+HCl(g) ![]() CH2ClCHClCH3(g)的活化能Ea(正)為132kJ·mol-1,則該反應的活化能Ea(逆)為___________kJ·mol-1。
CH2ClCHClCH3(g)的活化能Ea(正)為132kJ·mol-1,則該反應的活化能Ea(逆)為___________kJ·mol-1。
(2)一定溫度下,密閉容器中發生反應I和反應II,達到平衡后增大壓強,CH2ClCHClCH3的產率____________(填“增大”“減小”或“不變”),理由是_________________________________。
(3)起始時向某恒容絕熱容器中充入1 mol CH2=CHCH3和1 mol Cl2發生反應II,達到平衡時,容器內氣體壓強_________________(填“增大”“減小”或“不變”)。
(4)某研究小組向密閉容器中充入一定量的CH2=CHCH3和Cl2,分別在A、B兩種不同催化劑作用下發生反應,一段時間后測得CH2ClCHClCH3的產率與溫度的關系如圖所示。p點是否為對應溫度下CH2ClCHClCH3的平衡產率,_________填“是”或“否”)判斷理由是_______________________。

(5)一定溫度下,向恒容密閉容器中充入等物質的量的CH2=CHCH3(g)和Cl2(g)。在催化劑作用下發生反應I,容器內氣體的壓強隨時間的變化如下表所示。
時間/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
壓強/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用單位時間內氣體分壓的變化來表示反應速率,即![]()
②該溫度下,若平衡時HCl的體積分數為![]() ,則丙烯的平衡總轉化率
,則丙烯的平衡總轉化率![]() ____________;反應I的平衡常數Kp=____________________kPa-1(Kp為以分壓表示的平衡常數,保留小數點后2位)。
____________;反應I的平衡常數Kp=____________________kPa-1(Kp為以分壓表示的平衡常數,保留小數點后2位)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com