
科目: 來源: 題型:
【題目】合成具有良好生物降解性的有機高分子材料是有機化學研究的重要課題之一。聚醋酸乙烯酯(PVAc)水解生成的聚乙烯醇(PVA),具有良好生物降解性,常用于生產安全玻璃夾層材料PVB。有關合成路線如圖(部分反應條件和產物略去)。

已知:Ⅰ.RCHO+R’CH2CHO +H2O
+H2O
Ⅱ.![]() (R、R′可表示烴基或氫原子)
(R、R′可表示烴基或氫原子)
Ⅲ.A為飽和一元醇,其氧的質量分數約為34.8%,請回答:
(1)C中官能團的名稱為_____,該分子中最多有_____個原子共平面。
(2)D與苯甲醛反應的化學方程式為_____。
(3)③的反應類型是____。
(4)PVAc的結構簡式為____。
(5)寫出與F具有相同官能團的同分異構體的結構簡式____(任寫一種)。
(6)參照上述信息,設計合成路線以溴乙烷為原料(其他無機試劑任選)合成 。____。
。____。
查看答案和解析>>
科目: 來源: 題型:
【題目】![]() (三草酸合鐵酸鉀晶體)為翠綠色晶體,可用于攝影和藍色印刷,110℃失去結晶水,230℃分解。某化學研究小組對
(三草酸合鐵酸鉀晶體)為翠綠色晶體,可用于攝影和藍色印刷,110℃失去結晶水,230℃分解。某化學研究小組對![]() 受熱分解生成的氣體產物和固體產物進行探究。
受熱分解生成的氣體產物和固體產物進行探究。
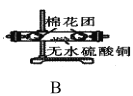
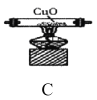
實驗I:探究實驗所得的氣體產物,按下圖裝置進行實驗(夾持儀器已略去,部分裝置可重復使用)。
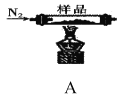



(1)實驗室常用飽和![]() 和飽和
和飽和![]() 的混合液制
的混合液制![]() ,反應的化學方程式為_____________。
,反應的化學方程式為_____________。
(2)裝置的連接順序為:A→__→__→__→__→__→F(填各裝置的字母代號)。
(3)檢查裝置氣密性后,先通一段時間![]() ,其目的是________,實驗結束時熄滅A、C兩處的酒精燈,繼續通
,其目的是________,實驗結束時熄滅A、C兩處的酒精燈,繼續通![]() 至常溫,其目的是__________。
至常溫,其目的是__________。
(4)實驗過程中觀察到F中的溶液變渾濁,C中有紅色固體生成,則氣體產物____(填化學式)。
(實驗二)分解產物中固體成分的探究
(5)定性實驗:經檢驗,固體成分含有![]() 。
。
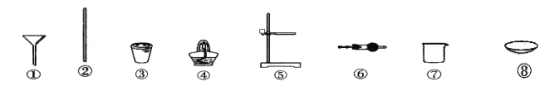
定量實驗:將固體產物加水溶解、過濾洗滌、干燥,得到含鐵樣品。完成上述實驗操作,需要用到下列儀器中的__________(填儀器編號)。
設計下列三種實驗方案分別對該含鐵樣品進行含量的測定
(甲方案)![]()
(乙方案)![]()
(丙方案)
![]()
你認為以上方案中可以確定樣品組成的有_____________方案。
(6)經測定產物中![]() ,寫出
,寫出![]() 分解的化學方程式_________。
分解的化學方程式_________。
查看答案和解析>>
科目: 來源: 題型:
【題目】關于室溫下下列溶液的說法不正確的是( )
編號 | ① | ② | ③ | ④ |
溶液 | 氨水 | 氫氧化鈉溶液 | 鹽酸 | 醋酸溶液 |
pH | 11 | 11 | 3 | 3 |
A. 水的電離程度:①=②=③=④
B. 分別加水稀釋10倍,溶液的pH:①>②>③>④
C. ①③兩溶液等體積混合:c(Cl-)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D. V1 L溶液②與V2 L溶液③混合,若V1∶V2=9∶11,則混合溶液pH=4(忽略溶液體積變化)
查看答案和解析>>
科目: 來源: 題型:
【題目】鐵及其化合物在生產生活中應用最廣泛,煉鐵技術和含鐵新材料的應用倍受關注。由此產生的![]() 等廢氣處理意義重大。
等廢氣處理意義重大。
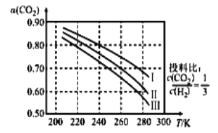
(1)將![]() 應用于生產清潔燃料甲醇,既能緩解溫室效應的影響,又能為能源的制備開辟新的渠道。其合成反應為
應用于生產清潔燃料甲醇,既能緩解溫室效應的影響,又能為能源的制備開辟新的渠道。其合成反應為![]() 。如圖為
。如圖為![]() 平衡轉化率和溫度、壓強的關系,其中壓強分別為
平衡轉化率和溫度、壓強的關系,其中壓強分別為![]() 。據圖可知,該反應為_______反應(填“吸熱”或“放熱”)。設
。據圖可知,該反應為_______反應(填“吸熱”或“放熱”)。設![]() 的初始濃度為
的初始濃度為![]() ,根據
,根據![]() 時的數據計算該反應的平衡常數
時的數據計算該反應的平衡常數![]() _________(列式即可)。若4.0Mpa時減小投料比
_________(列式即可)。若4.0Mpa時減小投料比![]() ,則
,則![]() 的平衡轉化率曲線可能位于II線的_________(填“上方”或“下方”)。
的平衡轉化率曲線可能位于II線的_________(填“上方”或“下方”)。
(2)![]() 時,向某恒溫密閉容器中加入一定量的
時,向某恒溫密閉容器中加入一定量的![]() 和
和![]() ,發生反應
,發生反應![]() ,反應達到平衡后,在
,反應達到平衡后,在![]() 時刻,改變某條件,
時刻,改變某條件,![]() 隨時間(t)的變化關系如圖1所示,則
隨時間(t)的變化關系如圖1所示,則![]() 時刻改變的條件可能是______(填寫字母)。
時刻改變的條件可能是______(填寫字母)。
a 保持溫度不變,壓縮容器 b 保持體積不變,升高溫度
c 保持體積不變,加少量碳粉 d 保持體積不變,增大![]() 濃度
濃度
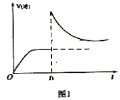
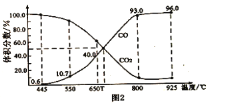
(3)在一定溫度下,向某體積可變的恒壓密閉容器(p總)加入1molCO2與足量的碳,發生反應![]() ,平衡時體系中氣體體積分數與溫度的關系如圖2所示,①650℃時,該反應達平衡后吸收的熱量是___________KJ。②
,平衡時體系中氣體體積分數與溫度的關系如圖2所示,①650℃時,該反應達平衡后吸收的熱量是___________KJ。②![]() 的混合氣體,平衡_______________(填“正向”、“逆向”或“不”)移動。
的混合氣體,平衡_______________(填“正向”、“逆向”或“不”)移動。
(4)已知25℃時,![]() ,此溫度下若在實驗室中配制100mL 5 molL1FeCl3溶液,為使配制過程中不出現渾濁現象,則至少需要加入2 molL1的鹽酸___________mL(忽略加入鹽酸體積)。
,此溫度下若在實驗室中配制100mL 5 molL1FeCl3溶液,為使配制過程中不出現渾濁現象,則至少需要加入2 molL1的鹽酸___________mL(忽略加入鹽酸體積)。
查看答案和解析>>
科目: 來源: 題型:
【題目】氮族元素在化學領域具有重要的地位。請回答下列問題:
(1)基態氮原子的價電子軌道表示式為__;第二周期的元素中,第一電離能介于B和N之間的元素有__種。
(2)雌黃的分子式為As2S3,其分子結構為![]() ,As原子的雜化類型為__。
,As原子的雜化類型為__。
(3)1mol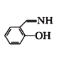 中所含σ鍵的物質的量為____mol。已知NF3與NH3分子的空間構型都是三角錐形,但NF3不易與Cu2+形成配離子,原因是__。
中所含σ鍵的物質的量為____mol。已知NF3與NH3分子的空間構型都是三角錐形,但NF3不易與Cu2+形成配離子,原因是__。
(4)紅鎳礦是一種重要的含鎳礦物,其主要成分的晶胞如圖所示,則每個Ni原子周圍與之緊鄰的As原子數為_____。以晶胞參數為單位長度建立的坐標系可以表示晶胞中各原子的位置,稱作原子分數坐標。磷化硼(BP)是一種超硬耐磨涂層材料,晶胞為正方體形,晶胞參數為apm。如圖為沿y軸投影的晶胞中所有硼原子的分布圖和原子分數坐標。設NA為阿伏伽德羅常數的值,1,2,3,4四點原子分數坐標分別為(0.25,0.25,0.75),(0.75,0.25,0.25),(0.25,0.75,0.25),(0.75,0.75,0.75)。據此推斷BP晶體的密度為__gcm-3。(用代數式表示)
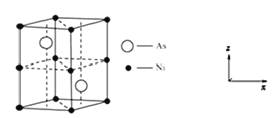
查看答案和解析>>
科目: 來源: 題型:
【題目】常溫下,用0.1000![]() NaOH溶液滴定20.00mL某未知濃度的CH3COOH溶液,滴定曲線如右圖所示。已知在點③處恰好中和。下列說法不正確的是( )
NaOH溶液滴定20.00mL某未知濃度的CH3COOH溶液,滴定曲線如右圖所示。已知在點③處恰好中和。下列說法不正確的是( )

A. 點①②③三處溶液中水的電離程度依次增大
B. 該溫度時CH3COOH的電離平衡常數約為![]()
C. 點①③處溶液中均有c(H+)=c(CH3COOH)+c(OH-)
D. 滴定過程中可能出現:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
查看答案和解析>>
科目: 來源: 題型:
【題目】下列圖示與對應的敘述相符的是
A.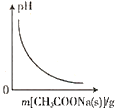 圖表示向CH3COOH溶液中逐步加入CH3COONa固體后,溶液pH的變化
圖表示向CH3COOH溶液中逐步加入CH3COONa固體后,溶液pH的變化
B.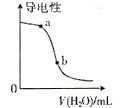 圖表示向醋酸溶液中加水時其導電性變化,則CH3COOH溶液的pH:a點>b點
圖表示向醋酸溶液中加水時其導電性變化,則CH3COOH溶液的pH:a點>b點
C.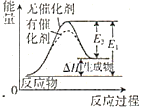 圖表示催化劑能改變化學反應的焓變
圖表示催化劑能改變化學反應的焓變
D. 圖表示等量NO2在容積相同的恒容密閉容器中,不同溫度下分別發生反應:2NO2(g)N2O4(g),相同時間后測得NO2含量的曲線,則該反應的△H<0
圖表示等量NO2在容積相同的恒容密閉容器中,不同溫度下分別發生反應:2NO2(g)N2O4(g),相同時間后測得NO2含量的曲線,則該反應的△H<0
查看答案和解析>>
科目: 來源: 題型:
【題目】工業上主要采用甲醇與CO的羰基化反應來制備乙酸,發生反應如下:CH3OH(g)+CO(g)=CH3COOH(l)。在恒壓密閉容器中通入0.20mol的CH3OH(g)和0.22mol的CO,測得甲醇的轉化率隨溫度變化如圖所示。已知在T2溫度下,達到平衡時容器的體積為2L。下列說法正確的是( )
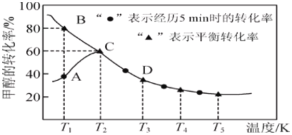
A.該反應的ΔH>0
B.縮小容器容積,既能加快反應速率,又能提高乙酸的產率
C.溫度為T1時,該反應的正反應速率:B點大于A點
D.溫度為T2時,向上述已達到平衡的恒壓容器中,再通入0.12molCH3OH和0.06molCO的混合氣體,平衡不移動
查看答案和解析>>
科目: 來源: 題型:
【題目】已知下列熱化學方程式:
(1)CH3COOH(l)+2O2(g)= 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
(2)C(s)+O2(g)= CO2(g) ΔH2=-393.5 kJ/mol
(3)H2(g)+![]() O2(g)= H2O(l) ΔH3=-285.8 kJ/mol
O2(g)= H2O(l) ΔH3=-285.8 kJ/mol
則反應2C(s)+2H2(g)+O2(g)= CH3COOH(l)的焓變為( ).
A.-488.3 kJ/molB.-244.15 kJ/molC.488.3 kJ/molD.244.15 kJ/mol
查看答案和解析>>
科目: 來源: 題型:
【題目】將亞磷酸氫二鈉(Na2HPO3)溶液通過電滲析法來制備亞磷酸(H3PO3)的原理如圖所示,下列有關說法錯誤的是

A.陽極的電極反應式為2H2O-4e-=4H++O2↑
B.在原料室與產品室間設計緩沖室的主要目的是提高產品的純度
C.陰極的電極反應式為2H2O+2e-=2OH-+H2↑
D.膜①、③、④均為陽離子交換膜
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com