
【題目】已知A--F六種有機化合物是重要的有機合成原料,結構簡式見下表,請根據要求回答下列問題:
化合物 | A | B | C |
結構簡式 |
|
|
|
化合物 | D | E | F |
結構簡式 |
|
|
|
![]() 寫出符合下列條件的A的同分異構體的結構簡式: ______ 。
寫出符合下列條件的A的同分異構體的結構簡式: ______ 。
A.核磁共振氫譜有4組峰
B.能發生水解反應
C.在加熱條件下能夠與新制的氫氧化銅懸濁液生成磚紅色沉淀
![]() 化合物B是制取抗心律失常藥物--氟卡尼的中間體,下列有關描述不正確的是______
化合物B是制取抗心律失常藥物--氟卡尼的中間體,下列有關描述不正確的是______ ![]() 填字母
填字母![]() 。
。
A.能與氯化鐵溶液顯色![]() 分子中含有羧基、羥基等官能團
分子中含有羧基、羥基等官能團
C.能與溴水反應![]() 能與碳酸鈉溶液反應產生二氧化碳
能與碳酸鈉溶液反應產生二氧化碳
![]() 化合物B在一定條件下,可以與NaOH溶液發生反應,則1mol化合物B最多需要NaOH的物質的量為 ______ 。
化合物B在一定條件下,可以與NaOH溶液發生反應,則1mol化合物B最多需要NaOH的物質的量為 ______ 。
![]() 化合物C與D在一定條件下發生如下轉化得到高分子化合物Z,部分產物已略去。
化合物C與D在一定條件下發生如下轉化得到高分子化合物Z,部分產物已略去。
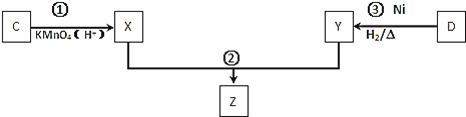
反應![]() 中D與
中D與![]() 按物質的量1:1反應生成Y,則反應
按物質的量1:1反應生成Y,則反應![]() 的化學方程式為 ______ 。
的化學方程式為 ______ 。
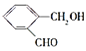
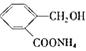
![]() 化合物D與銀氨溶液反應的化學方程式
化合物D與銀氨溶液反應的化學方程式![]() 有機物用結構簡式表示
有機物用結構簡式表示![]() : ______ 。
: ______ 。
![]() 化合物F是合成克矽平的原料之一,
化合物F是合成克矽平的原料之一,![]() 克矽平是一種治療矽肺病的藥物
克矽平是一種治療矽肺病的藥物![]() ,其合成路線如下
,其合成路線如下![]() 反應均在一定條件下進行
反應均在一定條件下進行![]() :
:

![]() 反應
反應![]() 是原子利用率
是原子利用率![]() 的反應,則該反應的化學方程式為 ______ ;
的反應,則該反應的化學方程式為 ______ ;
![]() 上述轉化關系中沒有涉及的反應類型是 ______
上述轉化關系中沒有涉及的反應類型是 ______ ![]() 填代號
填代號![]() 。
。
![]() 加成反應
加成反應![]() 消去反應
消去反應![]() 還原反應
還原反應![]() 氧化反應
氧化反應![]() 加聚反應
加聚反應![]() 取代反應。
取代反應。
【答案】![]() BD 3mol
BD 3mol 
 +2Ag(NH3)2OH
+2Ag(NH3)2OH![]()
 +2Ag+3NH3+H2O
+2Ag+3NH3+H2O ![]() +HCHO→
+HCHO→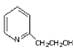
![]()
【解析】
![]() 的同分異構體符合條件:能發生水解反應,含有酯基,在加熱條件下能夠與新制的氫氧化銅懸濁液生成紅色沉淀,含有
的同分異構體符合條件:能發生水解反應,含有酯基,在加熱條件下能夠與新制的氫氧化銅懸濁液生成紅色沉淀,含有![]() ,結合A的分子式可知,應含有甲酸形成的酯基,側鏈為甲基、
,結合A的分子式可知,應含有甲酸形成的酯基,側鏈為甲基、![]() ,氫譜有4組峰,則甲基與
,氫譜有4組峰,則甲基與![]() 處于對位,該同分異構體結構簡式為
處于對位,該同分異構體結構簡式為![]() ,
,
故答案為:![]() ;
;
![]() 含有酚羥基,能與氯化鐵溶液發生顯色反應,故A正確;
含有酚羥基,能與氯化鐵溶液發生顯色反應,故A正確;
B.由結構簡式可知,B分子中含有酯基、羥基,故B錯誤;
C.B含有酚羥基,酚羥基鄰位含有氫原子,可以能與濃溴水反應取代反應,故C正確;
D.酚羥基不能與碳酸鈉溶液反應產生二氧化碳,故D錯誤,
故答案為:BD;
![]() 化合物B含有2mol酚羥基、1mol羧酸與醇形成的酯基,1molB最多需要NaOH的物質的量為3mol,
化合物B含有2mol酚羥基、1mol羧酸與醇形成的酯基,1molB最多需要NaOH的物質的量為3mol,
故答案為:3mol;
![]() 被酸性高錳酸鉀溶液氧化生成X為
被酸性高錳酸鉀溶液氧化生成X為![]() ,反應
,反應![]() 中D與
中D與![]() 按物質的量1:1反應生成Y,則Y為
按物質的量1:1反應生成Y,則Y為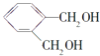 ,X與Y發生縮聚反應生成Z為
,X與Y發生縮聚反應生成Z為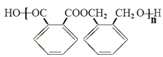 ,則反應
,則反應![]() 的化學方程式為:
的化學方程式為: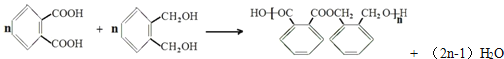 ,
,
故答案為: ;
;
![]() 化合物D與銀氨溶液反應方程式為:
化合物D與銀氨溶液反應方程式為: ,
,
故答案為: ;
;
![]() 反應
反應![]() 是原子利用率
是原子利用率![]() 的反應,由原子守恒可知,應是F與HCHO發生加成反應,反應
的反應,由原子守恒可知,應是F與HCHO發生加成反應,反應![]() 為濃硫酸、加熱條件下發生消去反應,反應
為濃硫酸、加熱條件下發生消去反應,反應![]() 為烯烴的加聚反應,反應
為烯烴的加聚反應,反應![]() 為氧化反應,
為氧化反應,
![]() 反應
反應![]() 是原子利用率
是原子利用率![]() 的反應,則該反應的化學方程式為:
的反應,則該反應的化學方程式為: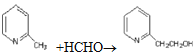 ,
,
故答案為: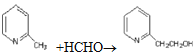 ;
;
![]() 由上述分析可知,上述轉化關系中涉及加成反應、消去反應、加聚反應、氧化反應,沒有涉及還原反應、取代反應,
由上述分析可知,上述轉化關系中涉及加成反應、消去反應、加聚反應、氧化反應,沒有涉及還原反應、取代反應,
故答案為:![]() 。
。


 挑戰100單元檢測試卷系列答案
挑戰100單元檢測試卷系列答案科目:高中化學 來源: 題型:
【題目】生成水的能量關系如圖所示:下列說法不正確的是
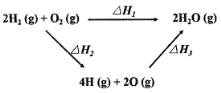
A.△H2>0
B.若2H2(g)+O2(g)=2H2O(l) △H4,則△H4<△H1
C.一定條件下,氣態原子生成1 mol H-O放出a kJ熱量,則該條件下△H3=-4akJ/mol
D.△H1+△H2+△H3=0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】紅葡萄酒密封儲存時間越長,質量越好,原因之一是儲存過程中生成了有香味的酯。在實驗室也可以用如圖所示的裝置制取乙酸乙酯,請回答下列問題。
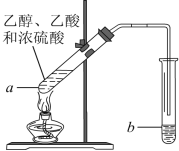
(1)乙醇分子中官能團的名稱是________________。
(2)試管a中加入幾塊碎瓷片的目的是_________。
(3)試管a中發生反應的化學方程式為___________________________________________,反應類型是____________________。
(4)反應開始前,試管b中盛放的溶液是_______________。
(5)可用____________的方法把制得的乙酸乙酯分離出來。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】航天飛機用鋁粉與高氯酸銨(NH4ClO4)的混合物為固體燃料,反應方程式表示為2NH4ClO4![]() N2↑+Cl2↑+2O2↑+4H2O。下列對該反應的敘述中錯誤的是( )
N2↑+Cl2↑+2O2↑+4H2O。下列對該反應的敘述中錯誤的是( )
A.瞬間產生大量高溫氣體推動航天飛機飛行
B.從能量變化的角度,主要是化學能轉變為熱能和動能
C.反應的焓變小于零
D.在方程式后增加ΔH及其數值即為熱化學方程式
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮及其化合物在工業上有重要用途。請回答下列有關問題:
(1)已知N2(g)+O2(g)=2NO(g) ΔH =+180.5kJ·mol-1,N2(g)+3H2(g) ![]() 2NH3(g)ΔH =-92.4kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1,寫出氨氣經催化氧化完全生成一氧化氮和水蒸氣的熱化學方程式為_________
2NH3(g)ΔH =-92.4kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1,寫出氨氣經催化氧化完全生成一氧化氮和水蒸氣的熱化學方程式為_________
(2)在一定體積的密閉容器中,進行如下化學反應:N2(g)+3H2(g) ![]() 2NH3(g),在恒溫恒壓下判斷該反應達到化學平衡狀態的依據是______(填序號);
2NH3(g),在恒溫恒壓下判斷該反應達到化學平衡狀態的依據是______(填序號);
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2) (正)=v(H2) (逆)
C.容器內壓強保持不變 D.混合氣體的密度保持不變
(3)在有氧條件下,新型催化劑M能催化![]() 與
與![]() 生成
生成![]() 。將一定比例的
。將一定比例的![]() 、
、![]() 和
和![]() 的混合氣體,勻速通入裝有催化劑M的反應器中反應(裝置見圖)。
的混合氣體,勻速通入裝有催化劑M的反應器中反應(裝置見圖)。
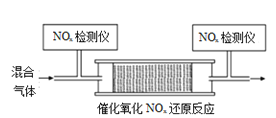
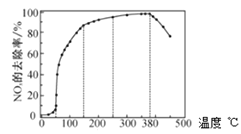
反應相同時間![]() 的去除率隨反應溫度的變化曲線如圖所示,在
的去除率隨反應溫度的變化曲線如圖所示,在![]() 范圍內隨著溫度的升高,
范圍內隨著溫度的升高,![]() 的去除率先迅速上升后上升緩慢,迅速上升段是催化劑活性隨溫度升高增大,與溫度升高共同使
的去除率先迅速上升后上升緩慢,迅速上升段是催化劑活性隨溫度升高增大,與溫度升高共同使![]() 去除反應速率迅速增大,上升階段緩慢主要是____________;當反應溫度高于
去除反應速率迅速增大,上升階段緩慢主要是____________;當反應溫度高于![]() 時,
時,![]() 的去除率迅速下降的原因可能是_________。
的去除率迅速下降的原因可能是_________。
(4)如圖為利用肼![]() —空氣燃料電池電解硫酸銅溶液的示意圖。
—空氣燃料電池電解硫酸銅溶液的示意圖。
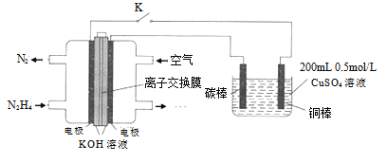
左圖負極反應式為:___________。當上圖陰極上放出2.24L氣體![]() 標準狀況
標準狀況![]() 時,圖中硫酸銅溶液的pH=______(溶液體積變化忽略不計)。
時,圖中硫酸銅溶液的pH=______(溶液體積變化忽略不計)。
(4)工業上生產尿素的化學方程式為:2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(l)。在T℃,體積為4L的密閉容器中,通入6mol NH3和3mol CO2 。10min反應達到平衡,達到平衡時,c(NH3)=0.5mol·L-1。則10min內的平均反應速率υ(CO2)=_______mol·L-1·min-1。若此時保持T℃和平衡時容器的壓強不變,再向體積可變的容器中充入3mol NH3,則此時反應的v正____ v逆(填“>”“<”或“=”)。
CO(NH2)2(s)+H2O(l)。在T℃,體積為4L的密閉容器中,通入6mol NH3和3mol CO2 。10min反應達到平衡,達到平衡時,c(NH3)=0.5mol·L-1。則10min內的平均反應速率υ(CO2)=_______mol·L-1·min-1。若此時保持T℃和平衡時容器的壓強不變,再向體積可變的容器中充入3mol NH3,則此時反應的v正____ v逆(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氣轉變為甲醇過程中,涉及如下反應:CO(g)+2H2(g)![]() CH3OH(g) △H=-90.8kJ/mol,現向體積為2L的恒容絕熱(起始溫度為T)密閉容器中充入1 mol CO和2 mol H2,反應經5min后達到平衡,測得CO的轉化率為50%。下列說法不正確的是
CH3OH(g) △H=-90.8kJ/mol,現向體積為2L的恒容絕熱(起始溫度為T)密閉容器中充入1 mol CO和2 mol H2,反應經5min后達到平衡,測得CO的轉化率為50%。下列說法不正確的是
A.在0~5min內,v(H2)=0.1 mol·L-1·min-1
B.當反應達到平衡時,CO和H2的物質的量之比為1:2
C.其他條件不變時,若將該體系換成恒溫(起始溫度為T)恒容密閉容器,則CO的平衡轉化率將增大
D.5min后,將甲醇液化分離出,此時平衡正向移動,正反應速率增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】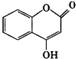 可用來制備抗凝血藥,通過如圖路線合成:
可用來制備抗凝血藥,通過如圖路線合成:
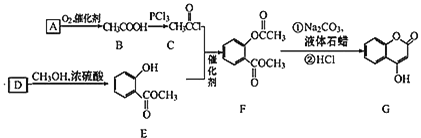
![]() 是一種氣態烴,寫出A的結構簡式 ______ ;
是一種氣態烴,寫出A的結構簡式 ______ ;
![]() 的反應類型是 ______ ;
的反應類型是 ______ ;
![]() 寫出
寫出![]() 的化學方程式 ______ ;
的化學方程式 ______ ;
![]() 下列關于G的說法正確的是 ______
下列關于G的說法正確的是 ______
![]() 能與溴單質反應
能與溴單質反應
![]() 能發生水解反應
能發生水解反應
![]() G最多能和5mol氫氣反應
G最多能和5mol氫氣反應
![]() 分子式是
分子式是![]()
![]() 寫出滿足以下條件的B的同系物所有同分異構體的結構簡式 ______
寫出滿足以下條件的B的同系物所有同分異構體的結構簡式 ______
![]() 分子式為
分子式為![]() 能發生銀鏡反應
能發生銀鏡反應![]() 能發生水解。
能發生水解。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,用0.1000 mol·L-1的NaOH溶液與25.00 mL 0.1000 mol·L-1HA(-元酸)溶液進行滴定實驗,得到滴定曲線(如圖所示),下列說法不正確的是
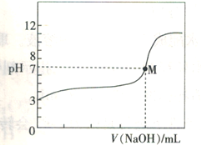
A.HA為-元弱酸
B.常溫下,HA的電離平衡常數Ka=10-5
C.M點時溶液的pH=7,此時加入的V(NaOH)<25.00 mL
D.可選用甲基橙作指示劑,到達滴定終點時溶液由紅色變為黃色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是實驗室制取SO2并驗證SO2的某些性質的裝置,試回答:
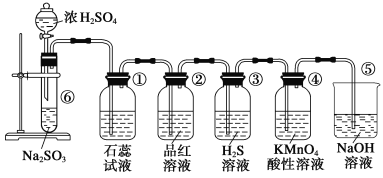
(1)在⑥中發生反應的化學方程式為___________。
(2)②中的品紅溶液__________,證明SO2有________性。
(3)④中的實驗現象是______,證明SO2有______性。
(4)⑤的作用是________,反應的化學方程式為________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com