
【題目】肉桂酸異戊酯( ![]() )是一種香料,一種合成路線如下:
)是一種香料,一種合成路線如下: 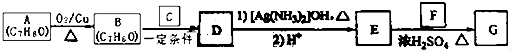 已知以下信息:
已知以下信息:
① ![]() ;
;
②C為甲醛的同系物,相同條件下其蒸氣與氫氣的密度比為22.
回答下列問題:
(1)A的化學名稱為 .
(2)B和C反應生成D的化學方程式為 .
(3)F中含有官能團的名稱為 .
(4)E和F反應生成G的化學方程式為 , 反應類型為 .
(5)F的同分異構體中不能與金屬鈉反應生成氫氣的共有種(不考慮立體異構),其中核磁共振氫譜只有兩組峰,且峰面積比為3:1的為寫結構簡式).
【答案】
(1)苯甲醇
(2)![]() +CH3CHO
+CH3CHO ![]() ?
? ![]() +H2O
+H2O
(3)羥基
(4)![]() +(CH3)2CHCH2CH2OH
+(CH3)2CHCH2CH2OH ![]() ?
? ![]() +H2O;酯化反應
+H2O;酯化反應
(5)6;(CH3)3COCH3
【解析】解:A的不飽和度為 ![]() =4,A經過系列轉化合成肉桂酸異戊酯G(
=4,A經過系列轉化合成肉桂酸異戊酯G( ![]() ),則A含苯環,可推知A為
),則A含苯環,可推知A為 ![]() ,則B為
,則B為 ![]() ,根據信息可得B、C反應為兩醛縮合,結合G的結構可判斷出用到了乙醛,即C為CH3CHO,則D為
,根據信息可得B、C反應為兩醛縮合,結合G的結構可判斷出用到了乙醛,即C為CH3CHO,則D為 ![]() ,E為
,E為 ![]() ,F為(CH3)2CHCH2CH2OH.
,F為(CH3)2CHCH2CH2OH.
(1.)由上述分析可知,A為 ![]() ,名稱為苯甲醇,所以答案是:苯甲醇;
,名稱為苯甲醇,所以答案是:苯甲醇;
(2.)B和C反應生成D的化學方程式為: ![]() +CH3CHO
+CH3CHO ![]()
![]() +H2O,所以答案是:
+H2O,所以答案是: ![]() +CH3CHO
+CH3CHO ![]()
![]() +H2O;
+H2O;
(3.)F為(CH3)2CHCH2CH2OH,含有官能團的名稱為羥基,所以答案是:羥基;
(4.)E和F反應生成G的化學方程式為: ![]() +(CH3)2CHCH2CH2OH
+(CH3)2CHCH2CH2OH ![]()
![]() +H2O,屬于酯化反應,所以答案是:
+H2O,屬于酯化反應,所以答案是: ![]() +(CH3)2CHCH2CH2OH
+(CH3)2CHCH2CH2OH ![]()
![]() +H2O;酯化反應;
+H2O;酯化反應;
(5.)(CH3)2CHCH2CH2OH的同分異構體不能與金屬鈉反應,只能是醚.醚的異構體以氧原子為分界:①左1個碳右4個碳(丁基),丁基有4種異構,則醚有4種異構體,②左2個碳右3個碳(丙基),丙基有2種異構,則醚有2種異構體,共6種,其中核磁共振氫譜只有兩組峰,且峰面積比為3:1的為(CH3)3COCH3 ,
所以答案是:6;(CH3)3COCH3 .


 陽光課堂課時作業系列答案
陽光課堂課時作業系列答案科目:高中化學 來源: 題型:
【題目】下列濃度關系正確的是( )
A. 0.1mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀剛好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H+)
B. 若將CO2通入0.1mol/LNa2CO3溶液至溶液中性,則溶液中: 2c(CO32-)+c(HCO3-)=0.1mol/L
C. 0.1mol/L的NaOH溶液與0.2mol/L的HCN溶液等體積混合,所得溶液呈堿性:c(Na+)>c(CN-)>c(HCN)>c(OH-)>c(H+)
D. 向1L 1mol/L的KOH熱溶液中通入一定量的Cl2,恰好完全反應生成氯酸鉀、次氯酸鉀和氯化鉀的混合溶液:c(K+)+c(H+)=6c(ClO3-)+2c(ClO-)+c(HClO)+c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業采用氯化銨焙燒菱錳礦制備碳酸錳的流程如下圖所示: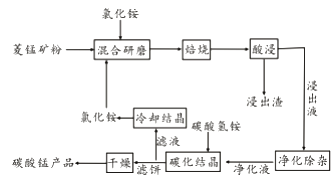
已知:①菱錳礦的主要成分是MnCO3 ,其中含Fe、Ca、Mg、Al等元素。
②焙燒過程中主要反應為:MnCO3 +2NH4Cl ![]() MnCl2+2NH3↑ +CO2↑+ H2O。
MnCl2+2NH3↑ +CO2↑+ H2O。
③部分陽離子沉淀時溶液的pH的值:
Al3- | Fe3+ | Ca2+ | Mn2+ | Mg2+ | |
開始沉淀的pH值 | 4.1 | 2.2 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH值 | 4.7 | 3.2 | 13.1 | 10.1 | 11.1 |
(1)實驗室“焙燒”操作盛放固體的儀器為。
(2)結合圖1、2、3,分析焙燒過程中對溫度、NH4Cl用量[m(NH4Cl):m(錳礦粉)]、時間的最佳選擇依次為、、。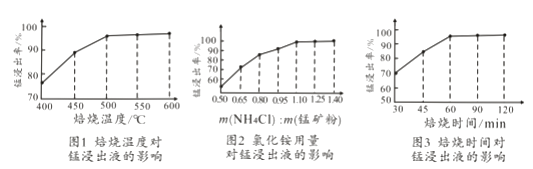
(3)對錳浸出液凈化除雜時,先加入MnO2將Fe2+轉化為Fe3+ , 再調節溶液pH的范圍為 , 將Fe3+和Al3+變為沉淀除去。然后加入NH4F將Ca2+、Mg2+變為氟化物沉淀除去。
(4)“碳化結晶”步驟中,加入碳酸氫銨是反應的離子方程式為。
(5)上述流程中可循環使用的物質是。
(6)為測定產品中碳酸錳的含量,設計如下實驗(雜質不參加反應):實驗步驟為:稱取16.80g試樣,溶于適量的稀硫酸溶液中,向所得溶液中加入稍過量的磷酸和硝酸,加熱使反應:2Mn2++NO3-+4PO43-+2H+ ![]() 2[Mn(PO4)2]3-+NO2-+H2O充分進行。除去溶液中存在的NO3-和NO2-后,加入l00.00mL2.00 mol·L-1的(NH4)2Fe(SO4)2溶液,發生的反應為:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO3-;再用1.00mol·L-1酸性K2Cr2O7溶液滴定過量的Fe2+ , 滴定終點時消耗10.00mL酸性K2Cr2O7溶液。
2[Mn(PO4)2]3-+NO2-+H2O充分進行。除去溶液中存在的NO3-和NO2-后,加入l00.00mL2.00 mol·L-1的(NH4)2Fe(SO4)2溶液,發生的反應為:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO3-;再用1.00mol·L-1酸性K2Cr2O7溶液滴定過量的Fe2+ , 滴定終點時消耗10.00mL酸性K2Cr2O7溶液。
①酸性K2Cr2O7溶液與Fe2+反應的離子方程式為(還原產物是Cr3+)。
②產品中碳酸錳的質量分數為(結果保留3位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列四個試管中,發生如下反應:Zn+2HCl=ZnCl2+H2↑,產生H2的反應速率最小的是( )
試管 | 鹽酸濃度 | 溫度 | 鋅的狀態 |
A | 0.5molL﹣1 | 20℃ | 塊 狀 |
B | 0.5molL﹣1 | 20℃ | 粉末狀 |
C | 2molL﹣1 | 35℃ | 塊 狀 |
D | 2molL﹣1 | 35℃ | 粉末狀 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是實驗室進行氯氣的制備及性質實驗的組合裝置,部分固定裝置未畫出。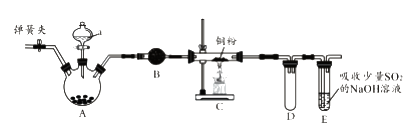
(1)A中固體是氯酸鉀,液體a是濃鹽酸,寫出該反應的化學方程式:。
(2)B為干燥裝置,加入的固體是;欲凈化氯氣,A、B間應添加一個盛有的洗氣瓶。
(3)C中的反應現象是;D的作用是。
(4)已知E中發生的反應為:Cl2+Na2SO3+2NaOH ![]() 2NaCl+Na2SO4+H2O。E中吸收尾氣一段時間后,吸收液(強堿性)中肯定存在:Cl-、OH-和SO42-。某興趣小組認為該吸收液中還可能存在ClO-和SO32-。
2NaCl+Na2SO4+H2O。E中吸收尾氣一段時間后,吸收液(強堿性)中肯定存在:Cl-、OH-和SO42-。某興趣小組認為該吸收液中還可能存在ClO-和SO32-。
a.甲同學認為該吸收液中ClO-和SO32-不能同時存在,其理由是(用離子方程式表示)。
b.乙同學為了檢驗吸收液中是否含有SO32- , 取少量吸收液于試管中,加適量稀硫酸酸化后,滴加品紅溶液,發現品紅溶液褪色。據此推斷該吸收液中一定有SO32-。乙同學的推斷是否正確?(填“正確”或“不正確”),理由是。
c.請設計實驗檢驗吸收液中是否含有ClO-(寫出實驗步驟、現象和結論)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】痕檢是公安機關提取犯罪嫌疑人指紋的一種重要的方法,AgNO3顯現法就是其中一種:人的手上有汗漬,用手動過白紙后,手指紋線就留在紙上。如果將溶液①小心涂到紙上,溶液①中的溶質就跟汗漬中的物質②作用,生成物質③,物質③在光照下,分解出的銀粒呈灰褐色,隨著反應的進行,銀粒逐漸增多,由棕色變成黑色的指紋線。用下列化學式表示這三種物質都正確的是 ( )
A.①AgNO3;②NaBr;③AgBr B.①AgNO3;②NaCl;③AgCl
C.①AgCl; ②AgNO3;③NaCl D.①AgNO3;②NaCl;③Ag
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com