
【題目】一定條件下,體積為10 L的密閉容器中,1 mol X和1 mol Y進行反應:2X(g)+Y(g) ![]() Z(g),經60 s達到平衡,生成0.3 mol Z。下列說法正確的是
Z(g),經60 s達到平衡,生成0.3 mol Z。下列說法正確的是
A. 若增大壓強,則物質Y的轉化率減小
B. 將容器體積變為20 L,Z的平衡濃度變為原來的![]()
C. 以X的濃度變化表示的反應速率為0.001 mol/(L·s)
D. 若升高溫度,X的體積分數增大,則該反應的ΔH >0
【答案】C
【解析】一定條件下,在容積為10L的密閉容器中,將1molX和1molY進行如下反應:2X(g)+Y(g)![]() Z(g),經60s達到平衡生成0.3mol的Z,則:
Z(g),經60s達到平衡生成0.3mol的Z,則:
2X(g)+Y(g)![]() Z(g)
Z(g)
起始量(mol) 1 1 0
變化量(mol) 0.6 0.3 0.3
平衡量(mol) 0.4 0.7 0.3
A.增大壓強,平衡正向移動,則物質Y的轉化率增大,故A錯誤;B.將容器體積變為20L,則體積增大,壓強減小,平衡逆向移動,Z的平衡濃度小于原來的![]() ,故B錯誤;C.以X濃度變化表示的反應速率為
,故B錯誤;C.以X濃度變化表示的反應速率為 =0.001mol/(Ls),故C正確;D.若升高溫度,X的體積分數增大,說明平衡逆向移動,則該反應的△H<0,故D錯誤;故選C。
=0.001mol/(Ls),故C正確;D.若升高溫度,X的體積分數增大,說明平衡逆向移動,則該反應的△H<0,故D錯誤;故選C。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】化學與生活密切相關。下列生活中常見物質的俗名與化學式相對應的是
A.生石灰—Ca(OH)2B.石灰石—CaCO3
C.燒堿—Na2CO3D.蘇打—NaHCO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】火力發電廠釋放出大量氮的氧化物(NOx)、二氧化硫等氣體會造成環境污染,對燃煤廢氣進行脫除處理。可實現綠色環保、低碳減排、廢物利用等目的。
(1)己知:N2 (g) +O2 (g) =2NO (g) △H=+180.5kJ·mol-1
C (s) +O2 (g)=CO2 (g) △H=-393.5 kJ·mol-1
2C (s) +O2(g) =2CO (g)△H=-221 kJ·mol-1
若某反應的平衡常數表達式為: 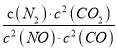 ,請寫出此反應的熱化學方程式_________。
,請寫出此反應的熱化學方程式_________。
(2)脫硝
利用甲烷與NO2反應,生成無污染的物質,則該反應的化學方程式為:___________。
(3)脫碳
將CO2轉化為甲醇的熱化學方程式為:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
①取五份等體積CO2和H2的混合氣體(物質的量之比均為1:3),分別加入溫度不同、容積相同的恒容密閉容器中,發生上述反應,反應相同時間后,測得甲醇的體積分數φ(CH3OH)與反應溫度T的關系曲線(見如圖1),則上述CO2轉化為甲醇反應的△H3_____0(填“>”、“<”或“=”)。
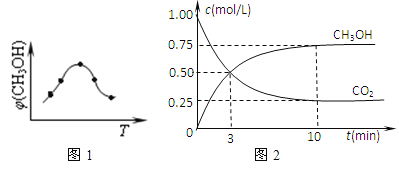
②在一恒溫恒容密閉容器中充入0.5molCO2和1.5molH2,進行上述反應.測得CO2和CH3OH(g)的濃度隨時間變化如上圖2所示.請回答:第10min后,若升溫,該反應的平衡常數將_____(填“變大”、“變小”、“不變”);若向該容器中再充入1molCO2和3molH2再次達到平衡時,則CH3OH(g)的體積分數將___(“變大”、“變小”、“不變”)。
(4)脫硫
某種脫硫工藝中將廢氣經處理后,與一定量的氨氣、潮濕的空氣反應,生成硫酸銨和硝酸銨的混合物作為副產品化肥.設煙氣中的SO2、NO2的物質的量之比為1:1,則該反應的化學方程式為__________。若在0.1mol/L的硝酸銨溶液中加入等體積的0.09mol/L氨水,配制了pH=8.2的溶液,則該溶液中微粒濃度由大到小的順序為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以下為工業從海水中提取液溴的流程圖:
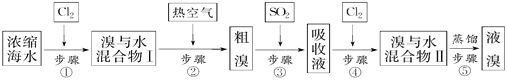
已知:溴的沸點為59 ℃,微溶于水,有毒性。請回答:
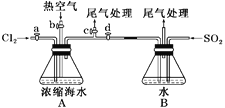
(1)某同學利用左下圖裝置進行步驟①至步驟④的實驗,當進行步驟①時,應關閉活塞_______,打開活塞____________。
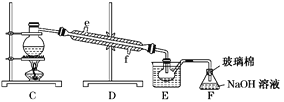
(2)步驟②中可根據____________________________現象,簡單判斷熱空氣的流速。
(3)步驟③中簡單判斷反應完全的依據是___________________________。
(4)從“溴水混合物Ⅰ”到“溴水混合物Ⅱ”的目的是___________________________。
(5)步驟⑤用右上圖裝置進行蒸餾,蒸餾燒瓶中尚未安裝溫度計,安裝其位置時應注意_____,裝置C中直接加熱不合理,應改為______,蒸餾時冷凝水應從______端進入(填“e”或“f”),圖中E、F的作用是________________、__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NaCl是一種化工原料,可以制備一系列物質,如下圖所示。下列說法正確的是

A. 石灰乳與Cl2的反應中,Cl2既是氧化劑又是還原劑
B. 25℃時,NaHCO3 在水中的溶解度比Na2CO3 大
C. Cl2與過量的鐵反應生成FeCl2
D. 圖示轉化反應都是氧化還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應既是氧化還原反應,又是化合反應的是( )
A.灼熱的碳與二氧化碳反應B.鋁片與稀硫酸的反應
C.甲烷在氧氣中的燃燒D.Ca(OH)2溶液與足量CO2反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】同分異構現象是有機化學中的一種普遍現象。互為同分異構體的物質不可能具有
A. 相同的相對分子質量 B. 相同的結構
C. 相同的通式 D. 相同的分子式
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)氯化銨的水溶液顯弱酸性,其原因為___________________(用離子方程式表示),0.1 molL-1的氨水中加入少量的NH4Cl固體,溶液的pH________(填“升高”或“降低”);若加入少量的明礬,溶液中的NH4+的濃度__________(填“增大”或“減小”);
(2)25℃,兩種酸的電離平衡常數如下表。
化學式 | CH3COOH | H2CO3 | HCN | HClO | H2SO3 |
電離常數 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 5×10-10 | 3.0×10-8 | K1=2×10-2 K2=1×10-7 |
①物質的量濃度均為0.1 mol/L的四種溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由大到小的順序為__________(用編號填寫)。
②根據上表數據判斷,下列離子方程式錯誤的是__________。
A.CO2(過量)+H2O+ClO-=HCO3-+HClO B.SO2(過量)+H2O+ClO-=HSO3-+HClO
C.CO2(少量)+H2O+CN-=HCO3-+HCN D.SO2(少量)+H2O+CN-=HSO3-+HCN
E.SO2(少量)+2CO32-+H2O=SO32-+2HCO3- F.2SO2(過量)+CO32-+H2O=2HSO3-+CO2↑
③0.10 molL-1Na2SO3溶液中離子濃度由大到小的順序為___________________。
④25℃時,NaCN與HCN的混合溶液,若c(CN-)=c(HCN),則溶液中pH=__________(已知lg2=0.3,lg5=0.7)。
⑤25℃時,若向NaHSO3溶液中加入少量的I2,則溶液中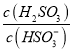 將__________(填“增大”“減小”或“不變”)。
將__________(填“增大”“減小”或“不變”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com