
【題目】某小組探究Br2、I2能否將Fe2+氧化,實驗如下。
實驗 | 試劑x | 現象及操作 |
| 溴水 | i.溶液呈黃色,取出少量滴加KSCN溶液,變紅 |
碘水 | ii.溶液呈黃色,取出少量滴加KSCN溶液,未變紅 |
(1)實驗ⅰ中產生Fe3+ 的離子方程式是________。
(2)以上實驗體現出氧化性關系:Br2_______I2(填“>”或“<”)。
(3)針對實驗ⅱ中未檢測到Fe3+,小組同學I2 +2Fe2+ ![]() 2Fe3+ + 2I-(反應a),限度小,產生的c(Fe3+)低;若向ⅱ的黃色溶液中加入AgNO3溶液,可產生黃色沉淀,平衡向_____移動,c(Fe3+)增大。
2Fe3+ + 2I-(反應a),限度小,產生的c(Fe3+)低;若向ⅱ的黃色溶液中加入AgNO3溶液,可產生黃色沉淀,平衡向_____移動,c(Fe3+)增大。
(4)針對小組同學的分析,進行實驗ⅲ:向ⅱ的黃色溶液中滴加足量AgNO3溶液。現象及操作如下:
Ⅰ.立即產生黃色沉淀,一段時間后,又有黑色固體從溶液中析出;取出少量黑色固體,洗滌后,_________(填操作和現象),證明黑色固體含有Ag。
Ⅱ.靜置,取上層溶液,用KSCN溶液檢驗,變紅;用CCl4萃取,無明顯現象。
(5)針對上述現象,小組同學提出不同觀點并對之進行研究。
① 觀點1:由產生黃色沉淀不能判斷反應a的平衡正向移動,說明理由:______。經證實觀點1合理。
② 觀點2:Fe3+ 可能由Ag+ 氧化產生。
實驗ⅳ:向FeSO4溶液滴加AgNO3溶液,_____(填現象、操作),觀點2合理。
(6)觀點1、2雖然合理,但加入AgNO3溶液能否使反應a的平衡移動,還需要進一步確認。設計實驗:取ⅱ的黃色溶液,______(填操作、現象)。由此得出結論:不能充分說明(4)中產生Fe3+的原因是由反應a的平衡移動造成的。
【答案】![]() > 正向 加入濃硝酸,黑色固體消失,生成紅棕色氣體。再向溶液中加入NaCl溶液,出現白色沉淀, 碘水與AgNO3溶液反應產生黃色沉淀, 生成黑色固體,向上層清液中加入KSCN溶液,變紅加入少量
> 正向 加入濃硝酸,黑色固體消失,生成紅棕色氣體。再向溶液中加入NaCl溶液,出現白色沉淀, 碘水與AgNO3溶液反應產生黃色沉淀, 生成黑色固體,向上層清液中加入KSCN溶液,變紅加入少量![]() 溶液,產生黃色沉淀后,立即向上層清液中加入過量KSCN溶液,不變紅
溶液,產生黃色沉淀后,立即向上層清液中加入過量KSCN溶液,不變紅
【解析】
(1)溴水具有氧化性,將Fe2+氧化;
(2)通過加入碘水的現象分析本質,依據氧化劑的氧化性大于氧化產物的氧化性,從而得出氧化性強弱;
(3)依據離子濃度的改變對化學平衡的影響作答;
(4)Ⅰ.Ag可以與濃硝酸反應產生紅棕色氣體,據此分析;
(5)①碘水中本身就有碘離子,可以與銀離子反應生成黃色的AgI沉淀;
②利用KSCN溶液探究是否有Fe3+的生成;
(6)綜上分析思路,待產生沉淀后立刻檢驗是否有Fe3+,來排除反應a平衡的干擾。
(1)根據實驗現象可知,溴水將將將Fe2+氧化轉化為將Fe3+,其離子方程式為:![]() ;
;
(2)當加入碘水后,溶液呈黃色,取出少量滴加KSCN溶液,未變紅,則證明碘水沒有將Fe2+氧化,則氧化性強弱:Fe2+>I2;上述實驗證明氧化性:Br2> Fe2+ >I2,所以以上實驗體現出氧化性關系:Br2>I2;
(3)若向ⅱ的黃色溶液中加入AgNO3溶液,可產生黃色沉淀,使反應a中的I-濃度降低,平衡向正向移動,故答案為:正向;
(4)Ⅰ.沉淀洗滌后,加入濃硝酸,黑色固體消失,生成紅棕色氣體,再向溶液中加入NaCl溶液,出現白色沉淀,則證明黑色固體為Ag;
(5)①碘水本身與AgNO3溶液反應產生黃色沉淀,因此不能證明反應a的平衡向正向移動;
②向FeSO4溶液滴加AgNO3溶液,若出現黑色沉淀,向上層清液中加入KSCN溶液,變紅,則證明Fe3+ 可能由Ag+ 氧化產生,故答案為:出現黑色沉淀,向上層清液中加入KSCN溶液,變紅;
(6)取ⅱ的黃色溶液,加入少量![]() 溶液,產生黃色沉淀后,立即向上層清液中加入過量KSCN溶液,不變紅。由此得出結論:不能充分說明(4)中產生Fe3+的原因是由反應a的平衡移動造成的。
溶液,產生黃色沉淀后,立即向上層清液中加入過量KSCN溶液,不變紅。由此得出結論:不能充分說明(4)中產生Fe3+的原因是由反應a的平衡移動造成的。


科目:高中化學 來源: 題型:
【題目】一定條件下,金屬鈉和CO2可制得金剛石:4Na+3CO2![]() 2Na2CO3+C(s,金剛石)
2Na2CO3+C(s,金剛石)
完成下列填空:
(1)上述反應中涉及的元素的原子半徑從大到小的順序為____。
(2)能證明碳元素與氧元素非金屬強弱的事實是___(選填編號)。
a.最高價氧化物水化物的酸性 b.兩種元素的氣態氫化物的沸點
c.CO2中元素的化合價 d.氣體氫化物受熱分解的溫度
(3)高壓下,科學家成功地將CO2轉化為具有類似SiO2結構的原子晶體,比較SiO2與CO2這兩種原子晶體的熔沸點高低,并說明理由:___。
常壓 | 熔點(℃) | 沸點(℃) |
鈉 | 97.8 | 882.9 |
Na2CO3 | 851 | 1850分解 |
金剛石 | 3550 | … |
石墨 | 3850 | 4250 |
(4)若在2L密閉容器中,10min內金屬鈉減少了0.2mol,則CO2的平均反應速率為___。該反應在常壓1000℃下進行,根據右表數據,該反應的平衡常數表達式K=___。
(5)若在2L密閉容器中,常壓、1000℃下,起始時,下列物理量能說明該反應已達到平衡狀態的是____。
a.氣體的平均摩爾質量不變 b.3v消耗(Na)=4v生成(CO2)
c.氣體的密度不變 d.![]() 的比值不變
的比值不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W四種化合物均由短周期元素組成。其中X含有四種元素,X、Y、Z的焰色反應均為黃色,W為無色無味氣體。這四種化合物具有如下圖轉化關系(部分反應物、產物及反應條件已略去)。請回答:
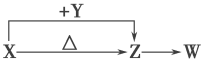
(1)Y的電子式是____________________。
(2)X與Y在溶液中反應的離子方程式是__________________________________________。
(3)X含有的四種元素之間(二種、三種或四種)可組成多種化合物,選用其中某些化合物,利用下圖裝置(夾持固定裝置已略去)進行實驗,裝置Ⅲ中產生白色沉淀,裝置Ⅴ中可收集到一種無色氣體。
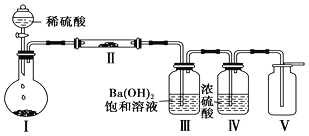
①裝置Ⅰ中反應的化學方程式是_________________________________________________,裝置Ⅱ中反應的化學方程式是________________________________________________。
②用X含有的四種元素中的兩種組成的某化合物,在催化劑存在下制備并收集純凈干燥的裝置Ⅴ中氣體,該化合物的化學式是___________,所需儀器裝置是_______________。 (從上圖選擇必要裝置,填寫編號)。
(4)向Z溶液中通入氯氣,可制得某種生產和生活中常用的漂白、消毒的物質,同時有X生成,該反應的化學方程式是__________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列指定反應的離子方程式正確的是
A. 飽和Na2CO3溶液與CaSO4固體反應:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO堿性溶液與Fe(OH)3反應:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 電解飽和食鹽水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】8.8g FeS與400mL 1 mol/L硝酸溶液恰好完全反應,反應后產物為Fe2(SO4)3和Fe(NO3)3, X、H2O,則X為( )
A.N2B.NOC.N2OD.NO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵及其化合物在生產生活及科學研究方面應用非常廣泛。回答下列問題:
(1)Fe原子的核外電子排布式為_________。
(2)含錳奧氏體鋼是一種特殊的鐵合金,主要由Fe和Mn組成,其中錳能增加鋼鐵的強度和硬度,提高耐沖擊性能和耐磨性能。第三電離能I3(Fe)____I3(Mn)(填“大于”或“小于”),原因___。
(3)工業電解熔融的FeO、Fe2O3冶煉高純鐵。FeO與Fe2O3相比,_____熔點高,其主要原因是_______。
(4)FeCl3可與KSCN溶液發生顯色反應。SCN-的三種元素中電負性最大的是_______。
(5)液態環戊二烯中存在的微粒間相互作用有____
A 范德華力 B 氫鍵 C ![]() 鍵 D π鍵
鍵 D π鍵
環戊二烯分子中碳原子的雜化軌道類型是_____
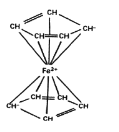
配合物中配體提供電子對的方式包括孤對電子、π電子等。二茂鐵的分子結構如圖所示,其中鐵的配位數是____。
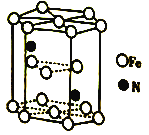
(6)Fe(CO)3與NH3在一定條件下可合成一種具有磁性的氮化鐵。該磁性氮化鐵的晶胞結構如圖所示。六棱柱底邊邊長為acm,高為ccm,阿伏加德羅常數的值為NA,該磁性氮化鐵的密度為____(列出計算式)g·cm-3。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四種位于不同主族的短周期元素X、Y、Z、W的原子序數依次增大,![]() 的內層電子與最外層電子數之比為2:5,Z和W位于同一周期。Z與W組成的化合物是常用的調味品,也是重要的醫用藥劑,工業上電解該化合物的熔融物可制得Z單質,Y和Z可形成兩種離子化合物,這兩種離子化合物的陰離子與陽離子數之比均為1:2。下列說法正確的是
的內層電子與最外層電子數之比為2:5,Z和W位于同一周期。Z與W組成的化合物是常用的調味品,也是重要的醫用藥劑,工業上電解該化合物的熔融物可制得Z單質,Y和Z可形成兩種離子化合物,這兩種離子化合物的陰離子與陽離子數之比均為1:2。下列說法正確的是
A. 四種元素中至少有兩種金屬元素
B. 四種元素的常見氫化物中熔點最高的是![]() 的氫化物
的氫化物
C. 四種元素形成的簡單高子中,離子半徑最小的是元素![]() 形成的離子
形成的離子
D. 常溫下,![]() 三種元素形成的化合物的水溶液的
三種元素形成的化合物的水溶液的![]() 小于7
小于7
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】隨著工農業發展,NH4Cl的價格低迷、需求降低導致利用“侯氏制堿法”生產的堿廠出現虧損。“新聯合制堿法”應運而生,流程如下:
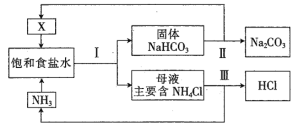
(1)寫出氣體X的結構式_______________________。
(2)上述工藝流程中參與循環使用的氣體有____________、____________。
(3)所得產品Na2CO3中不會含有NH4Cl,原因是__________________(用化學方程式表示)。
(4)過程III以MgO為催化劑進行轉化,示意圖如下:
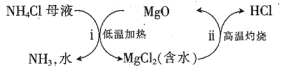
①步驟ii實際上要經過加熱和高溫兩步反應,“加熱”步驟制得HCl,“高溫”步驟得到MgO,其化學方程式分別為__________________、________。
②過程III分兩步得到NH3和HCl,比一步得到NH3和HCl的好處是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某待測液中可能含有Cu2+、Mg2+、Fe3+、K+、NH![]() 、Cl-等離子,現通過如下實驗對其中的陽離子進行檢驗:
、Cl-等離子,現通過如下實驗對其中的陽離子進行檢驗:
(1)取少量待測液,仔細觀察,呈無色。
(2)向上述待測液中滴加NaOH溶液,有白色沉淀生成;實驗過程中還有刺激性氣味的氣體產生,該氣體能使濕潤的紅色石蕊試紙變藍。
據此可以判斷該待測液中一定含有的陽離子是___,一定沒有的陽離子是___。還有一種陽離子沒有檢驗,檢驗這種離子的實驗方法是(填寫實驗名稱)___,現象是___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com