
【題目】已知碳化鈣(化學式為:CaC2)與水反應生成乙炔和Ca(OH)2。請以CaC2為碳源,其它無機試劑任選,寫出由CaC2分三步制取[分子式為(C2H3Cl)n]聚氯乙烯的化學方程式:
⑴第一步:___;
⑵第二步:___,反應類型:___;
⑶第三步:___,反應類型:___。
【答案】CaC2+2H2O=Ca(OH)2+C2H2↑ C2H2+HCl→CH2=CHCl 加成反應 nCH2=CHCl![]()
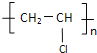 加聚反應
加聚反應
【解析】
由CaC2分三步制取聚氯乙烯,可以先用與水反應生成乙炔,乙炔與氯化氫加成得氯乙烯,氯乙烯再發生加聚反應得聚氯乙烯。
⑴第一步:由CaC2分三步制取聚氯乙烯,可以先用與水反應生成乙炔,反應方程式為CaC2+2H2O = Ca(OH)2+C2H2↑;故答案為:CaC2+2H2O = Ca(OH)2+C2H2↑。
⑵第二步:乙炔與氯化氫加成得氯乙烯,反應方程式為C2H2+HCl→CH2=CHCl,該反應為加成反應;故答案為:C2H2+HCl→CH2=CHCl;加成反應。
⑶第三步:氯乙烯再發生加聚反應得聚氯乙烯,反應方程式為nCH2=CHCl![]()
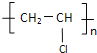 ,該反應為加聚反應,故答案為:nCH2=CHCl
,該反應為加聚反應,故答案為:nCH2=CHCl![]()
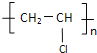 ;加聚反應。
;加聚反應。


科目:高中化學 來源: 題型:
【題目】某種化合物的結構如圖所示,其中X、Y、Z、Q、W為原子序數依次增大的五種短周期元素,Q核外最外層電子數與Y核外電子總數相同,X的原子半徑是元素周期表中最小的。下列敘述正確的是
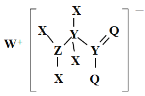
A.Z的最高價氧化物對應的水化物是一元強酸
B.WX的水溶液呈中性
C.元素非金屬性的順序為Y>Z>Q
D.該化合物中與Y單鍵相連的Q不滿足8電子穩定結構
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】制取水煤氣反應C(s)+H2O(g)CO(g)+H2(g),化學平衡常數表示為K=![]() ,有關化學平衡常數說法正確的是( )
,有關化學平衡常數說法正確的是( )
A.由表達式可知c(CO)與c(CO)增大時,K值增大
B.其他條件不變時,溫度升高,K值增大
C.化學平衡向右移動,K值增大
D.K值變化,化學平衡一定發生了移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋅銀電池能量大、電壓平穩,廣泛用于電子手表、照相機、計算器和其他微型電子儀器。電解質溶液是KOH溶液,電池總反應為Zn+Ag2O=ZnO+2Ag。請回答下列問題:
(1)該電池的正極材料是________;電池工作時,陽離子向________(填“正極”或“負極”)移動;負極的反應式為__________。
(2)①電極材料鋅可由閃鋅礦在空氣中煅燒成氧化鋅,然后用碳還原來制取,化學反應方程式為ZnO+C![]() Zn+CO↑,此法為_____。
Zn+CO↑,此法為_____。
A 電解法 B 熱還原法 C 熱分解法
(3)可用石墨作電極電解提純氫氧化鉀電解液。電解池內的陽離子交換膜只允許陽離子通過,其工作原理如圖所示。
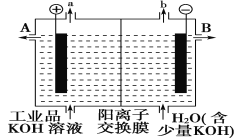
①該電解池的陽極,陰極反應式為陽極:_________陰極:________
②除去雜質后的氫氧化鉀溶液從出口________(填“A”或“B”)導出。
③在相同條件下,a處與b處產生的氣體體積比為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子的檢驗方法一定正確的是( )
A.向某溶液中滴加![]() 溶液,有白色沉淀,再滴加足量稀
溶液,有白色沉淀,再滴加足量稀![]() ,若沉淀不溶解,則原溶液中一定含
,若沉淀不溶解,則原溶液中一定含![]()
B.向某溶液中滴加![]() 溶液,若出現紅色則原溶液中含
溶液,若出現紅色則原溶液中含![]()
C.向某溶液中滴加足量稀鹽酸,產生氣體使澄清石灰水變渾濁,則原溶液中含![]()
D.用鉑絲蘸取某溶液在酒精燈火焰上灼燒,未觀察到紫色火焰,則原溶液中不含![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】表示下列反應的離子方程式正確的是( )
A.鈉與水反應:Na+H2O=Na++OH-+H2↑
B.NaOH溶液與稀硫酸反應:OH-+H+=H2O
C.鐵片和稀鹽酸反應:2Fe+6H+=2Fe3++3H2↑
D.石灰石與硝酸反應:C![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,將濃度均為![]() 的
的![]() 溶液和
溶液和![]() 溶液按體積分別為Va和Vb混合,保持
溶液按體積分別為Va和Vb混合,保持![]() ,且生成的
,且生成的![]() 可溶于水。已知
可溶于水。已知![]() 與混合液pH關系如圖。下列說法錯誤的是( )
與混合液pH關系如圖。下列說法錯誤的是( )
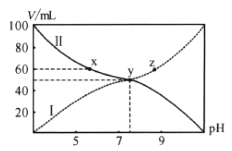
A.曲線Ⅰ表示![]() 溶液體積B.
溶液體積B.![]() 點存在
點存在![]()
C.電離平衡常數![]() D.向
D.向![]() 點溶液加入
點溶液加入![]() ,水的電離程度減小
,水的電離程度減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知HA的酸性弱于HB的酸性。25℃時,用NaOH固體分別改變物質的量濃度均為0.1molL-1的HA溶液和HB溶液的pH(溶液的體積變化忽略不計),溶液中A-、B-的物質的量濃度的負對數與溶液的pH的變化情況如圖所示。下列說法正確的是( )
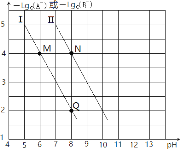
A.曲線Ⅰ表示溶液的pH與-lgc(A-)的變化關系
B.![]() =1000
=1000
C.溶液中水的電離程度:M>N
D.N點對應的溶液中c(Na+)<Q點對應的溶液中c(Na+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NO是重要化學物質。回答下列問題:
(1)工業生產硝酸時,首先氨氧化反應制備NO,寫出該反應的化學方程式:_____________。
(2)工廠排放尾氣中NO可用催化劑[La0.8A0.2BCoO3+x(A.B均為過渡元素)]脫除。研究表明,一定溫度下,NO的脫除率與還原劑(如H2)、催化劑以及催化劑表面氧缺位(※)的密集程度有關。催化機理如下:
第一階段:B4+(不穩定)+H2→低價態的金屬離子(還原前后催化劑中金屬原子的個數不變)
第二階段:NO(g)+※→NO(吸附態) H1、K1
2NO(吸附態)→2N(吸附態)+O2(g) △H2、K2
2N(吸附態)→N2(g)+2※ △H3、K3
2NO(吸附態)→N2(g) +2O(吸附態) H4、K4
2O(吸附態)→O2(g)+2※ △H5、K5
①第一階段用H2還原B4+得到低價態的金屬離子越多,第二階段反應的速率越快,其原因是__________________________________。
②根據第二階段可知,能量大小:NO(g)__________(填“>”“=”或“<”)NO(吸附態)。
③該溫度下,NO脫除反應2NO(g)![]() N2(g)+ O2(g)的平衡常數K=_____(用K1、K4、K5的表達式表示)。
N2(g)+ O2(g)的平衡常數K=_____(用K1、K4、K5的表達式表示)。
(3)物質的生成熱是指最穩定的單質合成1mol該物質所放出的熱量(H);單質的生成熱均為0。已知NO(g)、CO(g)、CO2(g)的生成熱分別為90.4kJ·mol-1、l10kJ·mol-1、393 kJ·mol-1。則一定條件下,NO(g)與CO(g)反應2NO(g) + 2CO(g)![]() N2(g)+2CO2(g)的△H=_____。
N2(g)+2CO2(g)的△H=_____。
(4)在2 L恒容密閉容器中充入4 mol CO和4 mol NO,發生反應2NO(g) +2CO(g)![]() N2(g)+ 2CO2(g),平衡時,NO的體積分數與溫度(℃)、壓強(Pa)的關系如圖所示。
N2(g)+ 2CO2(g),平衡時,NO的體積分數與溫度(℃)、壓強(Pa)的關系如圖所示。
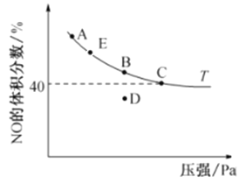
①C點NO的平衡轉化率為______;若C點在10 min達到平衡,則10 min內CO的平均反應速率為________。
②若起始容器內壓強為力P,則C點時該反應的平衡常數Kp=____ (用平衡分壓代替平衡濃度,分壓=總壓×物質的量分數)。
③若在D點對反應容器升溫的同時擴大體積使體系壓強減小,重新達到的平衡狀態可能是________________(從圖中A、B、C、E點選填)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com