
【題目】一定量的混合氣體在密閉容器中發生如下反應:![]() ,達到平衡后測得A氣體的濃度為
,達到平衡后測得A氣體的濃度為![]() ,保持溫度不變,將密閉容器的容積壓縮為原來的一半再次達到平衡后,測得A濃度為
,保持溫度不變,將密閉容器的容積壓縮為原來的一半再次達到平衡后,測得A濃度為![]() ,則下列敘述正確的是
,則下列敘述正確的是![]()
![]()
A.平衡向正反應方向移動B.![]()
C.B的物質的量濃度減小D.C的體積分數降低
【答案】A
【解析】
保持溫度不變,保持溫度不變將容器的容積縮為原來的一半,如平衡不移動,A的濃度為1mol/L,實際上A的濃度變為0.8mol/L,說明平衡向消耗A的方向移動,即向正反應移動,
A、由上述分析可知,平衡向正反應方向移動,選項A正確;
B、縮小體積,壓強增大,平衡向正反應移動,壓強增大平衡向氣體物質的量減小的方向移動,即x+y>n,選項B錯誤;
C、由上述分析可知,平衡雖然向正反應方向移動,B的量減小,但容器的體積縮小一半,故B的物質的量濃度比原來的大,但小于原來濃度的2倍,選項C錯誤;
D、平衡向正反應方向移動,氣體C的物質的量增大,故C的體積分數增大,選項D錯誤;
答案選A。


 暑假作業海燕出版社系列答案
暑假作業海燕出版社系列答案 本土教輔贏在暑假高效假期總復習云南科技出版社系列答案
本土教輔贏在暑假高效假期總復習云南科技出版社系列答案 暑假作業北京藝術與科學電子出版社系列答案
暑假作業北京藝術與科學電子出版社系列答案科目:高中化學 來源: 題型:
【題目】已知室溫時,0.1mo1/L某一元酸HA在水中有0.1%發生電離,下列敘述錯誤的是:
A. 該溶液的pH=4 B. 升高溫度,溶液的pH增大 C. 此酸的電離平衡常數約為1×10-7 D. 由HA電離出的c(H+)約為水電離出的c(H+)的106倍
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生用0.10 mol·L-1標準NaOH溶液滴定某濃度的鹽酸。記錄數據如下:
實驗 序號 | 待測液 體積/mL | 所消耗NaOH標準液的體積/mL | |
滴定前讀數/mL | 滴定后讀數/mL | ||
1 | 20.00 | 0.50 | 20.54 |
2 | 20.00 | 6.00 | 26.00 |
3 | 20.00 | 1.40 | 21.36 |

(1)滴定時選用酚酞試液作指示劑,如何判斷滴定達到終點____________。
(2)滴定過程中,眼睛應注視_____________________;
(3)鹽酸的物質的量濃度為___________。
(4)堿式滴定管尖嘴部分有氣泡,滴定后消失,對測定結果的影響是__________(填“偏高”“偏低”或“無影響”)。
(5)某同學用已知準確濃度的高錳酸鉀溶液滴定溶液中Fe2+的濃度,高錳酸鉀溶液應盛放在________(填“甲”或“乙”)中,該反應的離子方程式為_______________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物M是二苯乙炔類液晶材料的一種,最簡單的二苯乙炔類化合物是![]() 。以互為同系物的單取代芳烴A、G為原料合成M的一種路線(部分反應條件略去)如下:
。以互為同系物的單取代芳烴A、G為原料合成M的一種路線(部分反應條件略去)如下:
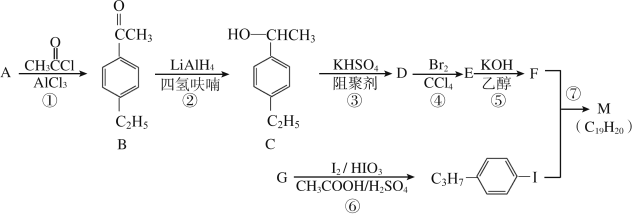
回答下列問題:
(1)A的結構簡式為_______。
(2)D分子中最多有_____個碳原子共平面,與D化學式相同且符合下列條件的同分異構體有__種。(①與D具有相同的官能團,②苯環上的三元取代物)
(3)①的反應類型是________。
(4)⑤的化學方程式為________。
(5)參照上述合成路線,設計一條由苯乙烯和甲苯為起始原料制備![]() 的合成路線:______________。
的合成路線:______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】相同溫度下,體積為2L的兩個恒容容器中發生:![]() 均為氣態物質
均為氣態物質![]() 有下表所示實驗數據:
有下表所示實驗數據:
容器編號 | 起始時各物質的物質的量 | 達到平衡時體系能量的變化 | ||
|
|
| ||
① | 1 | 3 | 0 |
|
② | 0 | 0 | 2 |
|
③ |
|
|
|
|
下列有關說法正確的是
A.![]()
B.②中![]() 的轉化率大于③中
的轉化率大于③中![]() 的轉化率
的轉化率
C.容器①與③分別達到平衡時,平衡常數相同,且![]()
D.將容器①的反應條件換為恒溫恒壓中進行![]() 投料量不變
投料量不變![]() ,達到平衡時,氣體平均摩爾質量較恒溫恒容時減小了
,達到平衡時,氣體平均摩爾質量較恒溫恒容時減小了
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一恒溫恒壓的密閉容器中發生如下反應:A(g)+B(g)2C(g) △H<0,t1時刻達到平衡后,在t2時刻改變某一條件,其反應過程如圖所示。下列說法不正確的是( )
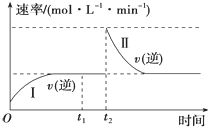
A.0~t2時,v(正)>v(逆)
B.Ⅰ、Ⅱ兩過程達到平衡時,A的體積分數Ⅰ=Ⅱ
C.t2時刻改變的條件是向密閉容器中加C
D.Ⅰ、Ⅱ兩過程達到平衡時,平衡常數K(Ⅰ)=K(Ⅱ)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國采用長征三號甲運載火箭成功發射了 “嫦娥一號” 衛星。肼(N2H4)是火箭發動機的一種燃料,反應時N2O4為氧化劑,反應生成N2和水蒸氣。已知:N2(g)+2O2(g)=N2O4(g) △H =+8.7kJ/mol,N2H4(g)+O2(g)=N2(g)+2H2O(g) △H= -534kJ/mol
下列表示肼和N2O4反應的熱化學方程式,正確的是 ( )
A.2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(l) △H=–1059.3 kJ/mo
B.N2H4(g) + ![]() N2O4(g) =
N2O4(g) =![]() N2(g) + 2H2O(g) △H=–542.7 kJ/mol
N2(g) + 2H2O(g) △H=–542.7 kJ/mol
C.2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(g) △H=–542.7 kJ/mol
D.2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(g) △H=–1076.7 kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知NA為阿伏加德羅常數的值,下列說法正確的是
A. 3gCO2中含有的質子數為1.5NA
B. 1L0.1mol·L-1 Na2SiO3溶液中含有的SiO32-數目為0.1NA
C. 0.1molH2O2分解產生O2時,轉移的電子數為0.2NA
D. 2.8g聚乙烯中含有的碳碳雙鍵數目為0.1NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用石墨電極電解100 mL H2SO4與CuSO4的混合溶液,通電一段時間后,兩極均收集到2.24 L氣體(標準狀況),則原混合溶液中Cu2+的物質的量濃度為( )
A.3 mol·L-1B.2 mol·L-1C.4 mol·L-1D.1 mol·L-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com