
【題目】25℃、101kPa下,稀強酸與稀強堿溶液反應中和熱為57.3kJ/mol。
(1)寫出表示稀H2SO4與稀燒堿溶液反應的中和熱的熱化學方程式:___。
(2)學生甲用50mL0.25mol/L硫酸與50mL0.55mol/L燒堿溶液測定中和熱裝置如圖。
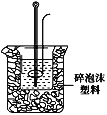
①實驗時所需的玻璃儀器除燒杯、量筒外還需:__。
②該裝置中有一處錯誤是:___。如果用該錯誤裝置測定,測得的中和熱ΔH會___(填“偏大、偏小、無影響”)。
③如果用60mL0.25mol/L硫酸與50mL0.55mol/LNaOH溶液進行反應,與上述實驗相比,所求中和熱___(填“相等、不相等”)。
④若反應前溶液以及中和后的混合液的密度均設為1g/cm3,混合前酸與堿的溫度均為t1,混合后溶液的溫度為t2,比熱容為4.18J/(g·℃),則中和熱ΔH=___。
(3)學生乙用2mol/L的硫酸來測定與鋅粒和鋅粉反應的快慢,設計如圖裝置:
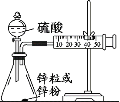
該生兩次實驗測定時間均設定為10min,則他還要測定的另一個數據是:___。
②若要減小產生H2的速率而又不影響產生H2的總量,應向硫酸中加入___(填字母)
a.Na2CO3溶液 b.K2SO4溶液 c.NaNO3溶液 d.水 e.CuSO4溶液
【答案】NaOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() Na2SO4(aq)+H2O(l) △H=-57.3kJ/mol 溫度計和環形玻璃攪拌棒 大燒杯上沒有蓋硬紙板或泡沫塑料板 偏大 相等 △H=
Na2SO4(aq)+H2O(l) △H=-57.3kJ/mol 溫度計和環形玻璃攪拌棒 大燒杯上沒有蓋硬紙板或泡沫塑料板 偏大 相等 △H=![]() kJ/mol 10min內注射器活塞移動的距離或10min內產生氫氣的體積 bd
kJ/mol 10min內注射器活塞移動的距離或10min內產生氫氣的體積 bd
【解析】
(1)根據酸堿中和熱的含義書寫熱化學方程式;
(2)①依據中和熱測定實驗的過程和儀器分析中和熱實驗時所需的玻璃儀器;
②根據所給的裝置圖,可知缺少硬紙板,大燒杯上如不蓋硬紙板,會使一部分熱量散失;
③強酸強堿的稀溶液,符合中和熱的測定條件;
④根據公式直接算出;
(3)①要測定反應速率,則還需要測定的另一個數據收集到氣體的體積;
②根據影響反應速率因素和實質發生的反應進行分析。
(1) 中和熱數值為57.3 kJ/mol,反應放熱,則中和熱的熱化學方程式:NaOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() Na2SO4(aq)+H2O(l) △H=-57.3kJ/mol,故答案為:NaOH(aq)+
Na2SO4(aq)+H2O(l) △H=-57.3kJ/mol,故答案為:NaOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() Na2SO4(aq)+H2O(l) △H=-57.3kJ/mol;
Na2SO4(aq)+H2O(l) △H=-57.3kJ/mol;
(2) ①依據量熱計的結果和原理分析,測定中和熱實驗時所需的玻璃儀器有燒杯、量筒、溫度計、環形玻璃攪拌棒,故答案為:溫度計、環形玻璃攪拌棒;
②實驗裝置保溫、隔熱效果必須好,否則影響實驗結果,所以裝置缺少硬紙板或泡沫塑料板,故答案為:大燒杯上沒有蓋硬紙板或泡沫塑料板;
③強酸強堿的稀溶液,符合中和熱的測定條件,所求中和熱相等,故答案為:相等;
④由公式:△H=![]() =
=![]() kJ/mol,故答案為:△H=
kJ/mol,故答案為:△H=![]() kJ/mol;
kJ/mol;
(3)①要測定反應速率,則還需要測定的另一個數據收集到氣體的體積,故答案為:10min內注射器活塞移動的距離或10min內產生氫氣的體積;
②如果反應過于劇烈,為了減緩反應速率而又不減少產生氫氣的量。a. 加入Na2CO3溶液,鹽酸與碳酸鈉反應,氫氣量減少,錯誤;b.加入K2SO4溶液,鹽酸的濃度減小,反應速率減小,正確;c.加入NaNO3溶液,硝酸具有強氧化性,不能放出氫氣,錯誤;d. 加入蒸餾水,鹽酸的濃度減小,反應速率減小,正確;e. 加入CuSO4溶液,鋅與銅離子反應置換出銅,氫氣量減少,錯誤;故答案為:bd。


科目:高中化學 來源: 題型:
【題目】常溫下,下列溶液中各組離子一定能大量共存的是
A.使石蕊試液呈紅色的溶液中:Na+、Al3+、NO3-、![]()
B.![]() =0.1 mol·L-1的溶液:Na+、K+、CO32-、NO3-
=0.1 mol·L-1的溶液:Na+、K+、CO32-、NO3-
C.含有0.1 mol·L-1 HCO3-的溶液:Na+、Fe3+、NO3-、SCN-
D.由水電離產生的c(H+)=10-12 mol·L-1的溶液:NH4+,SO42-、HCO3-、Cl-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】沒食子酸丙酯簡稱PG,是一種白色粉末,難溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化劑。其結構簡式如圖所示。
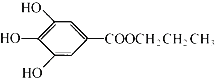
已知:PG經水解可轉化為沒食子酸,沒食子酸能與NaHCO3溶液反應生成CO2
回答下列問題:
(1)從分子結構或性質上看,PG具有抗氧化作用的主要原因是:______(文字簡述)
(2)1mol沒食子酸最多可以與含________mol碳酸鈉的溶液發生反應。
(3)寫出PG在NaOH溶液中水解的化學方程式:_______________________。
(4)沒食子酸有多種同分異構體,寫出其中符合下列要求的同分異構體的結構簡式:____。
a.含有苯環,且苯環上的一溴代物只有一種;
b.既能發生銀鏡反應,又能發生水解反應。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知下列熱化學方程式:Zn(s) +![]() O2(g) =ZnO(s) ΔH1=-351.1kJ/mol
O2(g) =ZnO(s) ΔH1=-351.1kJ/mol
Hg(l) +![]() O2(g) = HgO(s) ΔH2=-90.7kJ/mol
O2(g) = HgO(s) ΔH2=-90.7kJ/mol
由此可知Zn(s) + HgO(s) = ZnO(s) + Hg(l)的ΔH3,其中ΔH3的值是
A.-260.4 kJ/molB.-254.6 kJ/molC.-438.9 kJ/molD.-441.8 kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2SO2(g)+O2(g))![]() 2SO3(g)反應過程的能量變化如圖所示,已知1molSO2(g)被氧化為1molSO3(g)的ΔH=-akJ/mol(a﹥0)。回答下列問題:
2SO3(g)反應過程的能量變化如圖所示,已知1molSO2(g)被氧化為1molSO3(g)的ΔH=-akJ/mol(a﹥0)。回答下列問題:
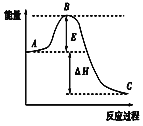
(1)圖中A表示:__,E的大小對該反應的反應熱ΔH__(填“是”或“否”)有影響。該反應通常用V2O5作催化劑,加V2O5會使圖中B點__(填“升高”或“降低”),理由是__。
(2)圖中ΔH=__kJ/mol。
(3)在一定溫度下,將2molSO2和1molO2放在一密閉容器中,在催化劑作用下充分反應。測得反應放出的熱量__(填“等于”、“大于”或“小于”)2akJ。
(4)V2O5的催化循環機理可能為:V2O5氧化SO2時,自己被還原為四價釩化合物;四價釩化合物再被氧氣氧化。寫出該催化循環機理的化學方程式:
①__;②4VO2+O2=2V2O5
(5)已知固態單質硫的燃燒熱為bkJ/mol,計算由S(s)生成3molSO3(g)的ΔH=___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用圖所示裝置檢驗乙烯時不需要除雜的是
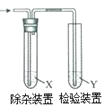
乙烯的制備 | 試劑X | 試劑Y | |
A | CH3CH2Br與NaOH乙醇溶液共熱 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br與NaOH乙醇溶液共熱 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH與濃H2SO4共熱至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH與濃H2SO4共熱至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常用藥﹣羥苯水楊胺,其合成路線如圖。回答下列問題:
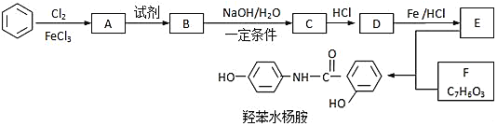
已知:![]()
(1)羥苯水楊胺的化學式為___。1mol羥苯水楊胺最多可以和___molNaOH反應。
(2)D中官能團的名稱___。
(3)A→B反應所加的試劑是___。
(4)F存在多種同分異構體。
F的同分異構體中既能與FeCl3發生顯色反應,又能發生銀鏡反應,且核磁共振氫譜顯示4組峰,峰面積之比為1:2:2:1的同分異構體的結構簡式___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】測定溶液電導率的變化是定量研究電解質在溶液中反應規律的一種方法,溶液電導率越大其導電能力越強。室溫下,用0.100molL-1的NH3H2O滴定10.00mL濃度均為0.100molL-1HCl和CH3COOH的混合溶液,所得電導率曲線如圖所示。下列說法正確的是( )
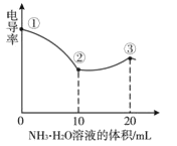
A.①點溶液:pH最大
B.溶液溫度:①高于②
C.③點溶液中:c(Cl-)>c(CH3COO-)
D.②點溶液中:c(NH4+)+c(NH3H2O)>c(CH3COOH)+c(CH3COO-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】稀氨水中存在著下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反應方向移動,同時使c(OH-)增大,應加入的物質或采取的措施是( )
NH4++OH-,若要使平衡向逆反應方向移動,同時使c(OH-)增大,應加入的物質或采取的措施是( )
①NH4Cl固體;②硫酸;③NaOH固體;④水;⑤加熱;⑥加入少量MgCl2固體。
A.①②③⑤B.③⑥C.③D.③⑤
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com