
【題目】下列熱化學方程式書寫正確的是(ΔH的絕對值均正確)
A. C2H5OH(l)+3O2(g)![]() 2CO2(g)+3H2O(g) ΔH=1 367.0 kJ/mol(燃燒熱)
2CO2(g)+3H2O(g) ΔH=1 367.0 kJ/mol(燃燒熱)
B. NaOH(aq)+HCl(aq)![]() NaCl(aq)+H2O(l) ΔH=+57.3 kJ/mol(中和熱)
NaCl(aq)+H2O(l) ΔH=+57.3 kJ/mol(中和熱)
C. S(s)+O2(g)![]() SO2(g) ΔH=296.8 kJ/mol(反應熱)
SO2(g) ΔH=296.8 kJ/mol(反應熱)
D. 2NO2![]() O2+2NO ΔH=+116.2 kJ/mol(反應熱)
O2+2NO ΔH=+116.2 kJ/mol(反應熱)
 科學實驗活動冊系列答案
科學實驗活動冊系列答案科目:高中化學 來源: 題型:
【題目】Ⅰ、火力發電廠釋放出大量氮氧化合物(NOx)、SO2和CO2等氣體會造成環境問題。對燃煤廢氣進行脫硝、脫硫和脫碳等處理,可實現綠色環保、節能減排、廢物利用等目的。
(1)脫硝。利用甲烷催化還原NOx:
CH4(g)+ 4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) △H1=-574 kJ/mol
CH4(g)+ 4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H2=-1160 kJ/mol
甲烷直接將NO2還原為N2的熱化學方程式為__________________________。
(2)脫碳。將CO2轉化為甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
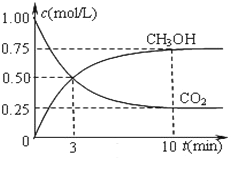
在一恒溫恒容密閉容器中充入1 mol CO2和3 mol H2進行反應。測得CO2和CH3OH(g)濃度隨時間變化如圖所示。回答:0~10 min內,氫氣的平均反應速率為___mol/(L·S);第10 min后,保持溫度不變,向該密閉容器中再充入1 mol CO2(g)和1 mol H2O(g),則平衡_________(填“正向”、“逆向”或“不”)移動。
Ⅱ、如下圖所示C、D、E、F、X、Y都是惰性電極。將電源接通后,向(乙)中滴入酚酞溶液,在F極附近顯紅色。
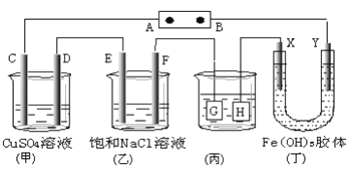
(1)若用甲醇、空氣燃料電池作電源,電解質為KOH溶液,則A極的電極反應式為_________________________
(2)欲用(丙)裝置給銅鍍銀,銀應該是 _____電極(填G或H)
(3)(丁)裝置中Y極附近紅褐色變_______(填深或淺)
(4)通電一段時間后,C、D、E、F電極均有單質生成,其物質的量之比為_____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質發生變化時,所克服的粒子間相互作用屬同種類型的是( )
A. 碘與干冰分別受熱變為氣體
B. 硝酸銨與硝酸分別受熱變為氣體
C. 氯化鈉與氯化氫分別溶解在水中
D. 晶體鈉與冰分別受熱熔化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.某課外活動小組將下圖所示裝置按一定順序連接,在實驗室里制取一定量的FeCl3(所通氣體過量并充分反應)。請回答下列問題:
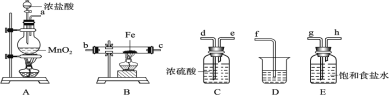
(1)A 中發生反應的化學方程式為________________________。在該反應中當 0.4molHCl發生反應時,生成標準狀況下的Cl2 的體積為______。濃鹽酸在反應中顯示出來的性質是__(填序號);
A.只有還原性 B.還原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)各裝置的正確連接順序為(填寫裝置代號)A→_____→_____→_____→D。
(3)裝置 E 的作用是_______。寫出裝置 D(D中所盛溶液為 NaOH)中反應的化學方程式_______
(4)工業上用電解法制備氯氣的化學方程式為:____________。
Ⅱ.某小組用CCl4萃取碘水中的碘,在下圖的分液漏斗中,下層液體呈__________色;他們打開分液漏斗活塞,卻未見液體流下,原因可能是__________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在2A+B![]() 3C+4D反應中,表示該反應速率最快的是( )
3C+4D反應中,表示該反應速率最快的是( )
A. υ(A)= 0.5 mol/(L·s) B. υ(B)= 18 mol/(L·min)
C. υ(C)= 0.8 mol/(L·s) D. υ(D)= 1 mol/( L·s)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇是重要的化工原料,又可稱為燃料。利用合成氣(主要成分為CO、CO2和H2)在催化劑的作用下合成甲醇,發生的主反應如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
(1)已知反應①中的相關的化學鍵鍵能數據如下:
化學鍵 | H—H | C—O | C≡O | H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此計算△H1=__________kJ·mol-1,已知△H2=-58kJ·mol-1,則△H3=_________kJ·mol-1
(2)反應①的化學平衡常數K的表達式為_______________;③的化學平衡常數K的表達式為_____________;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硝酸鈉(NaNO2)是一種工業鹽,外觀與食鹽相似。下面是某學習小組設計的NaNO2制取實驗和純度檢驗實驗。該小組收集了相關資料:
①SO2和HNO3溶液反應生成NOx和H2SO4
②3NO2-+2H+=2NO↑+NO3-+H2O
③NO2-+Ag+=AgNO2↓(AgNO2為淡黃色接近白色固體,在水中形成沉淀)
Ⅰ.亞硝酸鈉的制取實驗

(1)儀器a的名稱為________________________,A裝置中發生的化學反應方程式為_____________________________________________。
(2)B裝置中多孔球泡的作用是_________________________________________________。
(3)若裝置B中逸出的NO與NO2氣體物質的量之比為2∶1,則裝置B中發生反應的化學方程式為_________________________________________________________。
(4)實驗過程中需控制C裝置中溶液pH>7,否則C中生成的NaNO2的產量會下降,理由是_____________________________________________________。
(5)請根據題干所給信息設計實驗證明C裝置中有NO2產生:_________________________________。(限選用的試劑:稀硝酸、硝酸銀溶液、NaOH溶液)
Ⅱ.亞硝酸鈉的純度檢驗
已知:NO2-+MnO4-+H+→NO3-+Mn2++H2O
(6)反應結束后C中溶液通過結晶獲得NaNO2粗產品mg,溶解后稀釋至250mL,分別取25.00mL用cmol/L的酸性KMnO4溶液平行滴定三次,平均每次消耗酸性KMnO4溶液的體積為VmL。則粗產品中NaNO2的質量分數為_____________(用含c、V、m的式子表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定體積的密閉容器中,進行如下化學反應:CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
K為化學平衡常數,其中K和溫度的關系如下表:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
根據以上信息推斷以下說法正確的是
A. 此反應為放熱反應
B. 此反應只有達到平衡時,密閉容器中的壓強才不會變化
C. 此反應達到1 000℃時的反應速率比700℃時大
D. 該反應的化學平衡常數越大,反應物的轉化率越低
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇是人們開發和利用的一種新能源。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ·mol-1;
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ·mol-1
(1)甲醇蒸氣完全燃燒的熱化學方程式為_____________________________________
(2)反應②中的能量變化如圖所示,則ΔH2=__________。(用E1、E2的相關式子表示)

(3)H2(g)的燃燒熱為________。
(4)請你分析H2(g)作為能源比甲醇蒸氣作為能源的優點:________________(寫出兩點即可)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com