
【題目】四種短周期元素A、B、C、D的性質或結構信息如下:
信息:①原子半徑:A>B>C>D ②四種元素之間形成的某三種分子的比例模型及部分性質如下:
甲:![]() 是地球上最常見的物質之一,是所有生命體生存的重要資源,約占人體體重的三分之二。
是地球上最常見的物質之一,是所有生命體生存的重要資源,約占人體體重的三分之二。
乙:![]() 無色,無氣味并且易燃。是常見的一種化石能源。
無色,無氣味并且易燃。是常見的一種化石能源。
丙:![]() 有強氧化性的弱酸,見光易分解,具有漂白性,可以用于消毒殺菌。請根據上述信息回答下列問題。
有強氧化性的弱酸,見光易分解,具有漂白性,可以用于消毒殺菌。請根據上述信息回答下列問題。
(1)請寫出BC2分子的電子式:_______________。
(2)A所在周期中,E元素的單質還原性最強,F元素的氧化物具有兩性。E單質與甲反應有化合物X生成。請寫出以下兩個反應的離子方程式:
①A元素的單質與物質甲發生反應:_______________________________。
②F、C兩種元素組成的化合物Y可作為高溫結構陶瓷材料,X與Y兩種化合物在溶液中發生反應:_________________________________________。
(3)物質丁的元素組成和甲相同,丁分子具有18電子結構。向盛有一定濃度丁溶液的試管中,逐滴加入硫酸酸化的硫酸亞鐵溶液。滴加過程中試管中溶液變成深棕黃色;開始有少量氣泡出現(經驗證是氧氣),片刻后反應變得劇烈;繼續滴加溶液,靜置一段時間,試管底部出現紅褐色沉淀。請回答“片刻后反應變得劇烈”的原因可能是:
a________________________;b______________________。
(4)請你預測:如果發現了原子序數為116號的元素,它在周期表中的位置是_______,它屬于____________元素(填“金屬”或“非金屬”)
【答案】 ![]() Cl2+H2O===H++Cl-+HClO Al2O3+2OH-===2AlO
Cl2+H2O===H++Cl-+HClO Al2O3+2OH-===2AlO![]() +H2O 反應放熱,溫度升高 Fe3+有催化作用 第七周期ⅥA族 金屬
+H2O 反應放熱,溫度升高 Fe3+有催化作用 第七周期ⅥA族 金屬
【解析】四種短周期元素A、B、C、D,由信息②可知,甲為水、乙為甲烷、丙為次氯酸,再根據信息①原子半徑大小A>B>C>D可得,A為Cl元素、B為碳元素、C為氧元素、D為氫元素。
(1)CO2分子中碳原子與氧原子之間形成2對共用電子對,電子式為![]() ,故答案為:
,故答案為:![]() ;
;
(2)A所在周期中,E元素的單質還原性最強,則E是Na元素;F元素的某些鹽類常用作凈水劑,則F是Al元素;E單質與甲反應有化合物X,X為NaOH。
(2)①氯氣和水反應生成HCl和HClO,離子反應方程式為Cl2+H2O=H++Cl-+HClO,故答案為:Cl2+H2O═H++Cl-+HClO;
②Al、O兩種元素組成的化合物Y為Al2O3,氧化鋁和NaOH反應生成偏鋁酸鈉和水,離子反應方程式為Al2O3+2OH-=2AlO2-+H2O,故答案為:Al2O3+2OH-═2AlO2-+H2O;
(3)物質丁的元素組成和甲相同,丁分子具有18電子結構,則丁是雙氧水,向盛有一定濃度丁溶液的試管中,逐滴加入用少量稀硫酸酸化的硫酸亞鐵溶液。有少量氣泡出現(經驗證是氧氣),說明雙氧水分解生成氧氣,常溫時反應2H2O2=2H2O+O2↑較慢,因而開始氣泡少;隨著反應的進行溫度升高,并且被逐漸增多的Fe3+催化,使反應速率加快而劇烈;故答案為:反應放熱,溫度升高;Fe3+有催化作用;
(4)元素周期表的前六周期已填滿,所容納的元素種數是:2+8+8+18+18+32=86,而前七周期可容納元素的種數是:86+32=118;可見116號元素位于第七周期ⅥA族;周期表總從上到下元素的金屬性逐漸增強,已知第六周期的Po元素為金屬元素,則第116號元素為金屬元素,故答案為:第七周期ⅥA族;金屬。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】下列物質所含的分子數(或原子數)等于阿伏加德羅常數的是
A. 0.5mo1 C2H4 B. 11.2L(標準狀況) C2H2 氣體
C. 23g Na D. 9g H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是
①晶體中分子間作用力越大,分子越穩定 ②原子晶體中共價鍵越強,熔點越高 ③干冰是CO2分子通過氫鍵和分子間作用力有規則排列成的分子晶體 ④在Na2O和Na2O2晶體中,陰、陽離子數之比相等 ⑤正四面體構型的分子,鍵角都是109°28′,其晶體類型可能是原子晶體或分子晶體 ⑥分子晶體中都含有化學鍵 ⑦含4.8 g碳元素的金剛石晶體中的共價鍵的物質的量為0.8 mol
A. ①②③④⑤ B. ②④⑦ C. ⑤⑥⑦ D. ③④⑤⑥⑦
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氧化鋰是制取鋰和鋰的化合物的原料,用電解法制備氫氧化鋰的工作原理如圖所示,下列敘述不正確的是
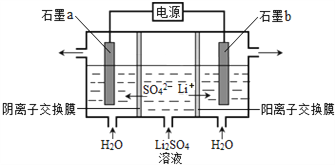
A. b極附近溶液的pH增大
B. a極發生的反應為:2H2O – 4e—= O2↑+4H+
C. 該法制備LiOH還可得到硫酸和氫氣等產品
D. 當電路中通過1 mol電子時,可得到2 molLiOH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有X、Y、Z、W、R、Q為前四周期元素,原子序數依次增大。X、Y最外層電子排布可表示為asa,bsbbpb(a≠b),Y、Z、W是位于P區的同一周期的元素,Y與W原子核外的未成對電子數相等,RW2與ZW2-為等電子體,Q為過渡金屬元素,其原子核外沒有未成對電子。請回答下列問題:
(1)Q的最外層電子排布式為_________ ,RW2的分子立體構型是_________________
(2)Y、Z、W的最簡單氫化物中,鍵角最小的是_______(用分子式表示), YW與Z2互為等電子體,ZW的結構式為____________(若有配位鍵,請用“→”表示)。
(3)ZX3可以與X+結合成ZX4+,這個過程中發生改變的是____(填序號)。

a.微粒的空間構型 b.Z原子的雜化類型
c.X-Z-X的鍵角 d.微粒的電子數
(4)QR在熒光體,光導體材料、涂料、顏料等行業中應用廣泛。立方QR晶體結構如圖所示,一個晶胞中含有的Q原子數為____________。與R原子最近且距離相等的R原子有_____個。該晶胞棱長與最近的兩個R原子的距離之比為_______
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以某種軟錳礦(主要成分MnO2,同時含有FeCO3、Al2O3、SiO2等)為主要原料生產KMnO4的一種流程圖如下:
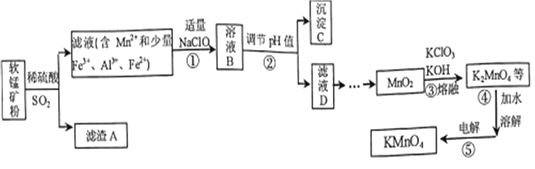
已知:Mn(OH)2極易被空氣氧化;Fe(OH)3、Al(OH)3的溶度積常數依次為4.0×10-38、1.3×10-33。
(1)濾渣A的化學式是_________;溶液B中的主要陰離子有______________。
(2)為避免引入雜質,②步調節pH加入的物質是____________;調節pH除雜過程中,后析出的
沉淀是________________。
(3)濃硫酸與MnO2反應也能生成Mn2+,其化學方程式是___________________。
(4) K2MnO4在酸性、中性環境下都會歧化生成MnO4-和MnO2,則③步原料應保證_______________。
④步溶解水應煮沸的目的是_____________________。
(5)⑤步的陽極電極反應式是____________;該法電解時要產生污染,其原因是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列溶液中的氯離子濃度與50 mL 1 mol/L的AlCl3溶液中氯離子濃度相等的是
A.150 mL 1 mol/L的NaCl B.75 mL 3 mol/L的NH4Cl
C.150 mL 2 mol/L的KCl D.75 mL 2 mol/L的CaCl2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】通過NO傳感器可監測汽車排放尾氣中NO含量,其工作原理如圖所示,下列說法正確的是

A. O2-向正極移動
B. 負極的電極反應式為:NO-2e-+O2-=NO2
C. O2的電極反應產物是H2O
D. 反應消耗的NO與O2的物質的量之比為1:2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成藥物異搏定路線中某一步驟如下:

下列說法錯誤的是
A. 物質X中所有碳原子可能在同一平面內
B. 可用FeCl3溶液鑒別Z中是否含有X
C. 等物質的量的X、Z 分別與H2加成,最多消耗H2的物質的量之比為3:5
D. 等物質的量的X、Y分別與NaOH反應,最多消耗NaOH的物質的量之比為1∶2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com