
【題目】某工業廢水中主要含有Cr3+,同時還含有少量的Fe3+、Fe2+、Al3+、Ca2+和Mg2+等,且酸性較強。為回收利用,通常采用如下流程處理:

注:部分陽離子常溫下以氫氧化物形式完全沉淀時溶液的pH見下表。
氫氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(1)氧化過程中可代替H2O2加入的試劑是________(填序號)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液調整溶液pH=8時,除去的離子是________;已知鈉離子交換樹脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交換除去的雜質離子是__________。
A.Fe3+B.Al3+C.Ca2+D.Mg2+
(3)還原過程中,每消耗0.8 mol Cr2O72-轉移4.8 mol e-,該反應離子方程式為____________。
【答案】A AB CD 3S2O32— + 4Cr2O72— + 26H+ = 6SO42— + 8Cr3+ +13H2O
【解析】
某工業廢水中主要含有Cr3+,同時還含有少量的Fe3+、Al3+、Ca2+和Mg2+等,加雙氧水把亞鐵離子氧化為鐵離子,同時Cr3+被氧化為Cr2O72-,加氫氧化鈉調節pH=8,則Fe3+、Al3+轉化為氫氧化鐵和氫氧化鋁沉淀,過濾,濾液中主要含有Cr2O72-、Ca2+和Mg2+等,通過鈉離子交換樹脂,除去Ca2+和Mg2+,然后加Na2S2O3把Cr2O72-還原為Cr3+,再調節pH得到Cr(OH)(H2O)5SO4;
(1)加氧化劑主要目的是把亞鐵離子氧化為鐵離子,注意不能引入新的雜質;
(2)根據表中數據判斷;通過鈉離子交換樹脂,除去Ca2+和Mg2+;
(3)每消耗0.8mol Cr2O72-轉移4.8mol e-,則1molCr2O72-轉移6mol電子,所以生成Cr3+,S2O32-被氧化為SO42-,結合得失電子守恒和原子守恒寫出離子方程式。
某工業廢水中主要含有Cr3+,同時還含有少量的Fe3+、Al3+、Ca2+和Mg2+等,加雙氧水把亞鐵離子氧化為鐵離子,同時Cr3+被氧化為Cr2O72-,加氫氧化鈉調節pH=8,則Fe3+、Al3+轉化為氫氧化鐵和氫氧化鋁沉淀,過濾,濾液中主要含有Cr2O72-、Ca2+和Mg2+等,通過鈉離子交換樹脂,除去Ca2+和Mg2+,然后加Na2S2O3把Cr2O72-還原為Cr3+,再調節pH得到Cr(OH)(H2O)5SO4;
(1)加氧化劑主要目的是把亞鐵離子氧化為鐵離子,同時不能引入新的雜質,所以可以用Na2O2代替H2O2,故答案為:A;
(2)根據表中數據可知,pH=8時,Fe3+、Al3+轉化為氫氧化鐵和氫氧化鋁沉淀,則Fe3+、Al3+被除去;通過鈉離子交換樹脂,除去Ca2+和Mg2+;
(3)每消耗0.8mol Cr2O72-轉移4.8mol e-,則1molCr2O72-轉移6mol電子,所以生成Cr3+,S2O32-被氧化為SO42-,則反應的離子方程式為:3S2O32— + 4Cr2O72— + 26H+ = 6SO42— + 8Cr3+ +13H2O。


 天天練口算系列答案
天天練口算系列答案科目:高中化學 來源: 題型:
【題目】短周期元素 X、Y、Z、W 原子序數依次增大,Y 與 W 同族。X、Y、Z 三種原子最外層電子數的關系 為 X+Z=Y。電解 Z 與 W 形成的化合物的水溶液,產生 W 元素的氣體單質,此氣體同冷燒堿溶液作 用,可得到化合物 ZWX 的溶液。下列說法正確的是
A.W 的氫化物穩定性強于 Y 的氫化物
B.Z與其他三種元素分別形成的化合物中只含有離子鍵
C.Z 與 Y 形成的化合物的水溶液呈堿性
D.對應的簡單離子半徑大小為 W >Z > X>Y
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨工業涉及固體燃料的氣化,需要研究CO2與CO之間的轉化。為了弄清其規律,讓一定量的CO2與足量碳在體積可變的密閉容器中反應C(s)+CO2(g)2CO(g) ΔH,測得壓強、溫度對CO、CO2的平衡組成的影響如圖所示:
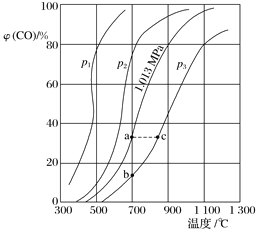
(1)p1、p2、p3的大小關系是_______,欲提高C與CO2反應中CO2的平衡轉化率,應采取的措施為___________________。圖中a、b、c三點對應的平衡常數(用Ka、Kb和Kc表示)大小關系是____________________;
(2)900 ℃、1.013 MPa時,1 mol CO2與足量碳反應達平衡后容器的體積為V,CO2的轉化率為__________,該反應的平衡常數K=________________。
(3)將(2)中平衡體系溫度降至640 ℃,壓強降至0.101 3 MPa,重新達到平衡后CO2的體積分數為50%。條件改變時,正反應和逆反應速率如何變化?_________________,二者之間有何關系?__________________。
(4)CO2催化加氫也可轉化為CO,但同時會合成二甲醚,其過程中主要發生下列反應:
反應Ⅰ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=41.2 kJ·mol-1
反應Ⅱ:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) ΔH=-122.5 kJ·mol-1
在恒壓、CO2和H2的起始量一定的條件下,CO2平衡轉化率和平衡時CH3OCH3的選擇性隨溫度的變化如圖
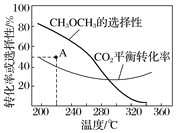
其中:CH3OCH3的選擇性=![]() ×100%
×100%
①溫度高于300 ℃,CO2平衡轉化率隨溫度升高而上升的原因是___________;
②220 ℃時,在催化劑作用下CO2與H2反應一段時間后,測得CH3OCH3的選擇性為48%(圖中A點)。不改變反應時間和溫度,一定能提高CH3OCH3選擇性的措施有________________。
(5)水煤氣變換[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工過程,主要用于合成氨、制氫以及合成氣加工等工業領域中。我國學者結合實驗與計算機模擬結果,研究了在金催化劑表面上水煤氣變換的反應歷程,如圖所示,其中吸附在金催化劑表面上的物種用*標注。
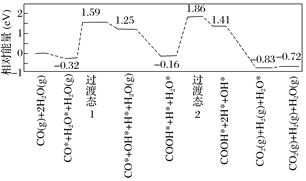
可知水煤氣變換的ΔH_______0(填“大于”、“等于”或“小于”)。該歷程中最大能壘(活化能)E正=_______eV,寫出該步驟的化學方程式____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以硫鐵礦(主要成分為![]() )為原料制備氯化鐵晶體(
)為原料制備氯化鐵晶體(![]() )的工藝流程如下所示:
)的工藝流程如下所示:

下列說法不正確的是
A. “酸溶”過程中使用的酸也可以是硝酸
B. 為防止污染,“焙燒”過程中產生的![]() 應回收利用
應回收利用
C. 通入氯氣的目的是氧化![]()
D. 用![]() 制取無水
制取無水![]() 時,需要在氯化氫氣流中加熱
時,需要在氯化氫氣流中加熱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用下圖所示裝置進行實驗,有關現象和解釋均正確的是
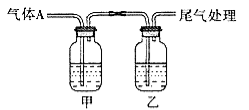
選項 | 足量A | 甲中試劑 | 乙中試劑 | 現象 | 解釋 |
A | CO2 | Na2SiO3溶液 | BaCl2 | 甲渾濁、乙澄清 | 酸性:HCl>H2CO3>H2SiO3 |
B | Cl2 | 紫色石蕊 | Fe(SCN)3 | 開始均變紅 | Cl2溶于水顯酸性 |
C | SO2 | 品紅溶液 | KMnO4 | 均褪色 | SO2具有漂白性 |
D | NH3 | AgNO3溶液 | AlCl3 | 現象相同 | NH3·H2O電離出OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如今環境保護越來越受重視,某化工集團為減少環境污染,提高資源的利用率、將鈦廠、氯堿廠、甲醇廠進行聯合生產。其主要生產工藝如下:(FeTiO3中Ti為+4價)

下列敘述正確的是( )
A.該流程中只有“電解”、“氯化”涉及氧化還原反應
B.“合成”反應中氧化劑與還原劑的物質的量之比為1:1
C.“氯化”時反應方程式為7Cl2+2FeTiO3+6C=2FeCl3+2TiCl4+6CO(條件省略)
D.上述流程中“Mg,Ar"可用“Mg,CO2”代替
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“綠水青山就是金山銀山”。目前人們對環境保護、新能源開發很重視,研究NO2、NO、CO、SO2等大氣污染物轉化為能參與大氣循環的物質,對建設美麗中國具有重要意義。
(1)有人設計通過硫循環完成CO的綜合處理,原理為
a.2CO(g)+SO2(g)![]() S(l)+2CO2(g) △H1= - 37.4kJ·mol-1
S(l)+2CO2(g) △H1= - 37.4kJ·mol-1
b.S(l)+2H2O(g)![]() 2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
則CO和水蒸氣完全反應生成H2和CO2的熱化學方程式為__________________________________。
(2)CO可在一定條件下轉化為CH3OH。已知:向2L密閉容器中通入2 molCO和4molH2,在適合的催化劑和T1溫度下,發生反應CO(g)+2H2(g)![]() CH3OH(g) △H<0,10min時達到平衡狀態,10min后改變溫度為T2,20min時達到平衡狀態,反應過程中部分數據見表:
CH3OH(g) △H<0,10min時達到平衡狀態,10min后改變溫度為T2,20min時達到平衡狀態,反應過程中部分數據見表:
反應時間 | CO(mol) | H2(mol) | CH3OH(mol) |
0min | 2 | 4 | 0 |
10min | 2 | ||
20min | 0.2 |
①前10min內的平均反應速率v(CO)= _______;在20min時,溫度T2下,該反應的化學平衡常數為________________。
②若30min時升高溫度,化學平衡常數值_______(填:“增大“減小”“不變”)。
③在T1溫度下,既能增大反應速率和提高CO平衡轉化率的措施有_____________(填兩種措施即可)
④在恒溫恒容下,下列可以判斷CO(g)+2H2(g)![]() CH3OH(g)反應達到平衡狀態的________(填序號)。
CH3OH(g)反應達到平衡狀態的________(填序號)。
a.2v正(H2)=v逆(CH3OH) b.混合氣體的物質的量不再變化
c.單位時間內有1 mol CO消耗同時消耗2molH2 d.混合氣體的平均相對分子質量不變
(3)已知反應2NO(g)+O2(g)![]() 2NO2的正反應速率v正=k1Cm(NO)Cn(O2),其中k1為速率常數,可通過下表實驗數據計算k1、m、n。
2NO2的正反應速率v正=k1Cm(NO)Cn(O2),其中k1為速率常數,可通過下表實驗數據計算k1、m、n。
組別 | 起始濃度/mol·L-1 | 初始速率/ mol·L-1·S-1 | |
NO | O2 | ||
1 | 0.02 | 0.0125 | 7.98×10-3 |
2 | 0.02 | 0.0250 | 15.96×10-3 |
3 | 0.04 | 0.0125 | 31.92×10-3 |
則k1=____, m =_____, n =_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1-丁炔的結構簡式是____________,它與過量溴加成后產物的名稱是_________;有機物A的分子式與1-丁炔相同,而且屬于同一類別,A與過量溴加成后產物的名稱是_______;與1-丁炔屬于同系物的且所含碳原子數最少的有機物是______,它能發生_______反應填反應類別制成導電塑料![]() ,這是21世紀具有廣闊前景的合成材料。
,這是21世紀具有廣闊前景的合成材料。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四種短周期元素X、Y、Z和W在周期表中的位置如圖所示,原子序數之和為48。下列說法不正確的是( )
X | Y | |
Z | W |
A.原子半徑大小比較:r(X)>r(Y)
B.X和W可形成共價化合物XW3
C.W的非金屬性比Z的弱
D.Z的最低價單核陰離子的失電子能力比Y的強
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com