
一次趣味化學活動中,王老師向同學們展示了一瓶標簽受損的無色溶液,如下圖所示。要求同學們進行探究:確認這瓶溶液到底是什么溶液?
【提出猜想】王老師提示:這瓶無色溶液只能是下了四種溶液中的一種:①硫酸鎂溶液、②硫酸鈉溶液、③硫酸溶液、④硫酸銨溶液
【查閱資料】(1)常溫下,相關物質的溶解度如下:
| 物質 | MgSO4 | Na2SO4 | (NH4)2SO4 | H2SO4 |
| 溶解度 | 35.1g | 19.5g | 75.4g | 與水任意比互溶 |
| 實驗操作 | 實驗現象 | 實驗結論 |
| ①取該溶液少許于試管中,向其中滴加幾滴 溶液 | 溶液中有白色沉淀生成 | 猜想①成立 |
| ②用玻璃棒蘸取少許原溶液滴在pH試紙水,并跟比色卡對照 | 溶液pH小于7 | 猜想③成立 |
| 實驗操作 | 實驗現象 | 實驗結論 |
| 取該溶液少許于試管中, | | 猜想④成立,該反應的化學方程式為 |
科目:初中化學 來源: 題型:探究題
(7分)實驗室里有一瓶常用的無色溶液,因保管不當,其殘缺的標簽中只剩下“Na”和“10%”字樣(如圖所示).
小強和小華同學很感興趣,決定對其成分進行探究.
【提出問題】這瓶試劑可能是什么溶液呢?
【交流討論】根據受損標簽的情況判斷,這瓶試劑不可能是 ( )
A.酸 B.堿 C.鹽
【查閱資料】
Ⅰ初中常見含鈉的化合物有:NaCl、NaOH、Na2CO3、NaHCO3.
ⅡNa2CO3和NaHCO3的水溶液都呈堿性.
Ⅲ室溫(20℃)時,測定四種物質的溶解度數據如下:
| 物質 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度g | 36 | 109 | 215 | 9.6 |
| 實驗步驟 | 實驗現象 | 結論及化學方程式 |
| 取少量溶液于試管中,滴加 | 產生大量氣泡 | 反應的化學方程式: |
| 把產生的氣體通入澄清的石灰水中. | 澄清的石灰水變渾濁 | 猜想②正確. 反應的化學方程式: |
查看答案和解析>>
科目:初中化學 來源: 題型:探究題
(6分)為了探究復分解反應的實質,某興趣小組同學對H2SO4與Ba(NO3)2的反應進行如下實驗探究。
【提出問題】物質發生復分解反應時,是不是所有的離子都參加了反應。
【設計實驗】
| 實驗步驟 | 實驗操作 | 實驗現象 |
| 第一步 | 取一支潔凈的試管,向其中加入一定量的稀硫酸溶液,再慢慢滴加Ba(NO3)2溶液至恰好完全反應。 | |
| 第二步 | 在上述反應后的試管中再滴加3滴紫色石蕊試液。 | 試管中溶液由無色變成紅色 |
查看答案和解析>>
科目:初中化學 來源: 題型:探究題
(22分)著名侯氏制堿法的重要反應之一:NH3 +CO2 +H2O+NaCl ="=" NaHCO3 +NH4Cl。在生產中,NaHCO3易結晶析出,經過濾得到NaHCO3晶體和濾液。某化學興趣小組欲探究所得濾液中溶質的成分,及制得的純堿樣品中Na2CO3的質量分數,請你參與他們的探究活動。
【查閱資料】Ⅰ.碳酸鈉和氯化鈣能發生復分解反應。
Ⅱ.2NaHCO3 △ Na2CO3 +CO2↑+H2O; NH4Cl △ NH3↑+HCl↑。
Ⅲ.NaCl溶液與AgNO3溶液反應產生不溶于稀HNO3的白色沉淀。
【探究實驗1】濾液中含有的溶質是什么?
【作出猜想】猜想1:NH4Cl 猜想2:NaHCO3 猜想3:NaCl
猜想4:……
【交流與討論】(1)化學興趣小組認為溶質含有NaCl,理由是 。
(2)化學興趣小組經過討論,認為猜想4可能是 。
【實驗推斷】
| 實驗步驟 | 實驗現象 | 實驗結論及分析 |
| ①取少量濾液于試管中,滴加足量的NaOH濃溶液后加熱,并將濕潤的紅色石蕊試紙放在試管口。 | | 濾液中含有NH4Cl,有關化學方程式: NaOH + NH4Cl =" NaCl" + NH3↑+ H2O |
| ②另取少量濾液于試管中,滴加稀鹽酸。 | 產生無色 無味氣體。 | 濾液中含有 ,有關化學方程式: 。 |
| ③另取少量濾液蒸干后充分灼燒,取灼燒后的殘余固體溶于水,滴加稀HNO3,再滴加AgNO3溶液。 | 產生白色沉淀。 | 濾液中含有 ,濾液蒸干后充分灼燒的目的是 。 |
| 實驗操作 | 實驗現象 | 實驗結論 |
| 取一定量純堿樣品配成溶液后,滴加過量的CaCl2溶液。 | 產生白色沉淀。 | 反應的化學方程式: 。 |
查看答案和解析>>
科目:初中化學 來源: 題型:探究題
(10分)二十一世紀是海洋開發與利用的世紀,某市規劃確立了“藍色經濟”發展戰略,海洋化學資源的綜合利用將是重點發展領域之一。以下是某研究性學習小組在探究海水綜合利用中遇到的問題,請你參與探究:
問題一、海水制鎂過程中如何富集鎂離子?
甲、乙、丙三位同學各自提出自己的設想:
甲:直接往海水中加入石灰乳。
乙:高溫加熱蒸發海水后,加入石灰乳。
丙:向曬鹽后的鹵水中,加入石灰乳。
通過分析比較,你認為___________的設想最為經濟合理(選填“甲”、“乙”或“丙”)。
問題二、粗鹽提純過程中如何除去可溶性雜質?
【查閱資料】
粗鹽中含有硫酸鈉、氯化鈣等可溶性雜質。
【設計實驗】
提純時,先向粗鹽水中加過量的氫氧化鋇溶液,目的是_____①________;再加過量的____②______,除盡雜質陽離子;濾去沉淀,向濾液中加入__③_____,將溶液的pH調為7,即得到精鹽水。
問題三、海水“制堿” 的產物成分是什么?
同學們從某企業取回少量碳酸氫鈉受熱完全分解后的固體樣品,為確定其成分,進行
了如下探究:
【提出猜想】
甲的猜想:樣品中只含有碳酸鈉;
乙的猜想:樣品中只含有氫氧化鈉;
丙的猜想:樣品中含有碳酸鈉和氫氧化鈉。
他們做出上述三種猜想的科學依據是________________________________。
【實驗、記錄與分析】
| 步驟 | 實驗操作 | 實驗現象 | 結論 |
| 1 | 取少量樣品于試管中,加水完全 溶解,再加入________________ | _____________________ | 乙的猜想 不成立 |
| 2 | 取步驟1反應后的溶液于試管中 ___________________________ | 無明顯現象 | 只有甲的 猜想成立 |
查看答案和解析>>
科目:初中化學 來源: 題型:探究題
KOH溶液中含有H2O、K+、OH-、能使無色酚酞試液變成紅色。某化學興趣小組想探究KOH溶液使無色酚酞試液變成紅色的原因。
【提出問題】KOH溶液中的什么成分使無色酚酞試液變紅?
【猜想】猜想1:KOH溶液中的H2O使無色酚酞試液變紅。
猜想2:KOH溶液中的K+使無色酚酞試液變紅。
猜想3:KOH溶液中的 (填化學式)使無色酚酞試液變紅。
【實驗探究】
| 實驗操作 | 實驗現象 | 結論 |
| ①用試管取少量蒸餾水,滴入1-2滴無色酚酞試液 | 反應② 試管內溶液不變色 | 猜想1不成立 |
| ②用試管取少量KCl溶液,滴入1-2滴無色酚酞試液 | ________________ | 猜想2不成立 |
| ③________________,滴入1-2滴無色酚酞試液 | 試管內溶液變紅 | ________________ |
查看答案和解析>>
科目:初中化學 來源: 題型:探究題
如圖所示,某興趣小組在進行酸堿中和反應的實驗探究時,向燒杯中氫氧化鈉溶液中滴加稀鹽酸一會兒后,發現忘記滴加指示劑,甲同學從燒杯中取少量反應后的溶液于一支試管中,并向試管中滴加幾滴無色酚酞試液,振蕩,觀察到酚酞試液不變色。
請寫出該中和反應方程式: 。
(1)猜想與假設:
猜想一:甲同學:“兩種物質已恰好完全中和,溶液呈中性”;
猜想二:乙同學:“反應后氫氧化鈉過量,溶液呈堿性”;
猜想三:丙同學: 。
甲、丙兩位同學經過討論后覺得乙同學的猜想不正確,兩位同學的理由是: 。
(2)設計并進行實驗:
①為了驗證自己的猜想,甲同學設計了以下實驗方案:
| 實驗步驟 | 實驗現象 | 實驗結論 |
| 用潔凈干燥的玻璃棒蘸取少量反應后的溶液滴在干燥的pH試紙上,觀察顏色變化并與標準比色卡對比。 | pH (填“>”、“=”或“<”)7 | 猜想一不成立 |
| 實驗步驟 | 實驗現象 | 實驗結論 |
| | | |
| 實驗步驟 | 實驗現象 | 實驗結論 |
| | | |
查看答案和解析>>
科目:初中化學 來源: 題型:探究題
小王和小張兩位同學對實驗探究有一定的心得,以下是他們探究鹽酸和氫氧化鈉溶液的實錄,請你參與探究并完成相關的問題:小王根據下圖的操作進行實驗:
(1)A的現象是 ;
(2)B中隨著稀鹽酸的滴加左面圖象能正確表示這個變化過程的是 (填字母序號);
(3)小王認為,當B中溶液顏色剛好變成無色時,說明鹽酸與氫氧化鈉溶液恰好完全反應,此時溶液呈中性。
(4)小張實驗:先向氫氧化鈉溶液中滴加一定量的稀鹽酸,再滴入酚酞試液,酚酞試液不變色,小張認為鹽酸和氫氧化鈉剛好完全反應。小干認為小張的實驗設計思路不合理,理由是 。
查看答案和解析>>
科目:初中化學 來源: 題型:信息分析題
(10分)過氧化鈣(CaO2)是一種對環境友好的多功能無機化合物,通常有兩種制備方法。已知:溫度過高過氧化鈣會分解生成氧化物和氧氣。
方法1:由Ca(OH)2為原料最終制得,其制備流程如下:
方法2:由雞蛋殼(含CaCO3高達90%)為原料最終反應制得,其制備流程如下: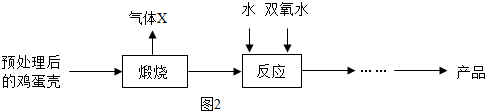
(1)方法1中攪拌的目的是 。請將攪拌過程中發生反應的化學方程式補充完整:
CaCl2 + H2O2 + 2NH3·H2O + 6 = CaO2·8H2O↓+ 2NH4Cl。制備過程中除水外可循環使用的物質是 (填化學式);
(2)方法2中氣體X是 ,實驗室常用 溶液來吸收。煅燒后的反應時化合反應,也能生成CaO2·8H2O,反應的化學方程式為 。該反應需控制溫度在0 ~ 2℃,可將反應器放置在 中,獲得CaO2產品中主要含有的固體雜質是 (填化學式);
(3)這兩種制法均要求在低溫下進行(除煅燒外),溫度過高除了防止氨水揮發外,還能 ;
(4)“綠色化學”一般是指反應物的原子全部轉化為期望的最終產物,則上述兩種方法中生成CaO2·8H2O的反應符合“綠色化學”的是 (填“方法1”或“方法2”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com