
原電池與電解
教學目標
知識技能:通過復習掌握原電池、電解、電鍍、金屬的腐蝕和防護原理。
能力培養(yǎng):根據(jù)知識點的復習培養(yǎng)總結(jié)、歸納的能力,培養(yǎng)應用所學知識解決實際問題的能力。
科學思想:應用電化學的知識綜合、歸納,理論聯(lián)系實際。
科學方法:應用實驗研究問題的方法。
重點、難點 原電池與電解池的比較。
教學過程設計
教師活動
一、電化學知識點的復習
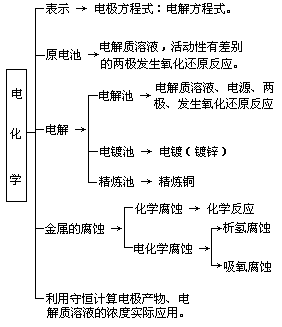
1.常見的電池
【設問】
①構(gòu)成原電池的材料是什么呢?
②原電池的原理是什么呢?
③它的原理與電解池有什么不同?
④常見的電池的類型?
看錄像或投影:
回答:
①原電池是由金屬與金屬或非金屬,電解質(zhì)溶液構(gòu)成的。
②原電池是由化學能轉(zhuǎn)化為電能的裝置。
③它的原理與電解池不同,因為電解池是由電能轉(zhuǎn)化為化學能的裝置。
④常見的電池有:干電池;蓄電池。
幾種電池示意圖:
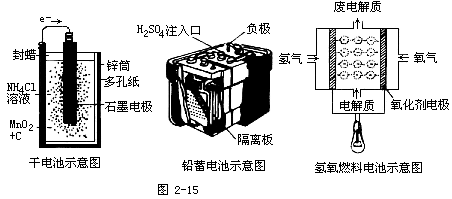
【設問】
根據(jù)示意圖你能說明電池的種類嗎?
回答:
鋅錳電池(干電池)、鉛蓄電池、燃燒電池(氫氧燃燒電池、甲烷燃燒電池)等。
【設問】
①電池的兩極各發(fā)生了什么反應?
②電池正、負兩極應該如何確定?
它的兩極與電解池的兩極有什么不同點?
③在可逆電池中,充電、放電過程是應用了原電池的原理還是電解池的原理?
回答:
①活潑的金屬為負極,發(fā)生氧化反應。
不活潑的金屬為正極,發(fā)生還原反應。
②原電池與電解池的兩極不相同,表現(xiàn)在:原電池活潑金屬是負極,而電解池與電源負極相互聯(lián)結(jié)的就是負極(陰極)。
原電池兩極金屬的金屬活動性必須不同,而電解池兩極可以是惰性電極,也可以是金屬電極。
③放電的過程是應用了原電池的原理,而充電過程應用了電解池的原理。
【講解】
電池可以分為可逆電池和不可逆電池,比如:干電池、燃燒電池等都是不可逆電池,它們在發(fā)生反應時有氣體或生成的物質(zhì)無法在相同的條件下返回,所以,稱為不可逆電池。
【設問1】
請舉例說明不可逆電池(展示學生解剖的干電池)?
干電池的兩極材料是什么?
電解質(zhì)溶液是什么?
兩極反應式如何書寫?
總反應如何書寫?
回答1:
如:鋅-錳電池
兩極材料是Zn、MnO2
電解質(zhì)溶液是:NH4Cl
負極:Zn-2e=Zn2+
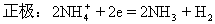
總反應:Zn+2NH4=Zn2++2NH3↑+2H2↑
【評價】糾正學生的錯誤,寫出正確的反應。
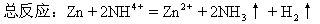
【設問2】
還有什么實例呢?
兩極材料是什么呢?
電解質(zhì)溶液是什么呢?
回答2:
再如:鋅-銅電池,負極-Zn,正極-Cu。
負極:Zn-2e=Zn2+,電解質(zhì)溶液――稀硫酸。
正極:2H++2e=2H=H2
總反應:2H++Zn=H2↑+Zn2+
什么是可逆電池呢?(看前面的圖)
誰能寫出兩極反應式?
總反應式又如何書寫呢?
(教師指導學生書寫)
鉛蓄電池是可逆電池
兩極反應式:
負極:Pb-2e=Pb2+
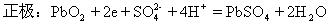
總反應:
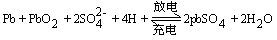
【練習】
書寫兩極反應式。
若有:
(1)銅、鋅、稀硫酸
(2)銅、鐵在潮濕的空氣中的腐蝕
(3)鋅、鐵放在食鹽水中
(4)氫、氧燃燒電池(電池的產(chǎn)物負極為H2O,正極則有大量的氫氧根生成)
(5)甲烷燃燒電池(電池負極甲烷燃燒失去電子,在堿性條件下

根據(jù)信息寫出(4)、(5)的電池總反應式。
板演:
(1)負極:Zn-2e=Zn2+
正極:2H++2e=2H=H2
(2)負極:2Fe-4e=2Fe2+
正極:O2+4e+2H2O=4OH-
(3)負極:2Zn-4e=2Zn2+
正極:O2+4e+2H2O=4OH-
(4)負極:2H2+4OH--4e=4H2O
正極:O2+4e+2H2O=4OH-
總反應:2H2+O2=2H2O</PGN0097.TXT/PGN>
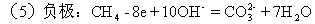
正極:2O2+8e+4H2O=8OH-
【設問】
誰能夠?qū)⑷紵姵匦〗Y(jié)一下呢?
回答:
在燃燒電池反應中確定哪一極發(fā)生的是什么反應的關鍵是:
負極發(fā)生氧化反應,化合價升高,失去電子;
總反應式為:兩極反應的加合;
書寫反應時,還應該注意得失電子數(shù)目應該守恒。
【評價】回答的很好。
燃燒電池反應中確定哪一極發(fā)生的是什么反應的關鍵是:
負極:化合價升高,失去電子,發(fā)生氧化反應;
正極:化合價降低,得到電子發(fā)生還原反應。
2.分析電解應用的主要方法和思路
【設問】
電解質(zhì)在通電前、通電后的關鍵點是什么呢?
在電解時離子的放電規(guī)律是什么呢?
電解的結(jié)果:溶液的濃度、酸堿性有無變化?
回答:
通電前:電解質(zhì)溶液的電離(它包括了電解質(zhì)的電離也包括了水的電離)。
通電后:離子才有定向的移動(陰離子移向陽極,陽離子移向陰極)。
放電規(guī)律:
陽極:
金屬陽極>S2->I->Cl->OH->含氧酸根
陰極:
Ag+>Cu2+>Pb2+>Fe2+>Zn2+>H+>Mg2+
溶液的離子濃度可能發(fā)生變化如:電解氯化銅、鹽酸等離子濃度發(fā)生了變化。
因為溶液中的氫離子或氫氧根離子放電,所以酸堿性可能發(fā)生改變。
請同學們看下列的歸納表格。
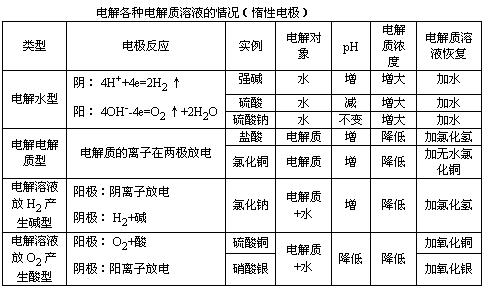
3.原電池、電解池、電鍍池的判
斷規(guī)律
(1)若無外接電源,可能是原電池,依據(jù)原電池的形成條件判斷,主要有“三看”。
【設問】看什么呢?
回答:
看電極;看溶液;看回路。
【投影】
先看電極:兩極為導體且活潑性不同,有一個先發(fā)生化學反應。
再看溶液:兩極插入電解質(zhì)溶液中。
【設問】
這樣就可以形成電池了嗎?
回答:
不能。
對,還應該看回路:形成閉合回路或者兩極板相接觸。
【設問】
若有外接電源,兩極插入電解質(zhì)溶液,并有回路,可能是什么池?
回答:
是電解池。
【評價】不完全正確。(糾正后看投影)
(2)若有外接電源,兩極插入電解質(zhì)溶液,可能是電解池或者是電鍍池。
【設問】為什么呢?
回答:
當陽極金屬與電解質(zhì)溶液中的陽離子相同時,則為電鍍池,其余的情況是電解池。
【評價】很好,根據(jù)電解液、根據(jù)陽極的電極材料,確定電解或電鍍。
二、電化學的應用
1.原電池原理的應用
【設問】
請同學們根據(jù)已經(jīng)復習的知識回答原電池原理的應用及依據(jù)?
回答:
應用到實際中有:
(1)由電極反應現(xiàn)象確定原電池的正極和負極,用來判斷電極金屬活動性強弱。
(2)分析判斷金屬腐蝕的快慢程度。
(3)由電池反應分析判斷新的化學能源的變化,判斷放電、充電。
【投影】
【評價】學生總結(jié)的很好,看以下歸納。
根據(jù)學生的回答小結(jié):
原電池原理的三個應用和依據(jù):
(1)電極反應現(xiàn)象判斷正極和負極,以確定金屬的活動性。其依據(jù)是:原電池的正極上現(xiàn)象是:有氣體產(chǎn)生,電極質(zhì)量不變或增加;負極上的現(xiàn)象是:電極不斷溶解,質(zhì)量減少。
(2)分析判斷金屬腐蝕的速率,分析判斷的依據(jù),對某一個指定金屬其腐蝕快慢順序是:
作電解池的陽極>作原電池的負極>非電池中的該金屬>作原電池的正極>作電解池的陰極。
判斷依據(jù):
(1)根據(jù)反應現(xiàn)象原電池中溶解的一方為負極,金屬活動性強。
(2)根據(jù)反應的速度判斷強弱。
(3)根據(jù)反應的條件判斷強弱。</PGN0100.TXT/PGN>
(3)由電池反應分析判斷新的化學能源的變化,分析的思路是先分析電池反應有關物質(zhì)化合價的變化,確定原電池的正極和負極,然后根據(jù)兩極的變化分析其它指定物質(zhì)的變化。
【練習】
1.下列五個燒杯中均有天然水
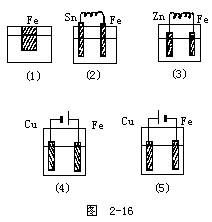
鐵被腐蝕由快到慢的順序是:______。
回答:
從圖和復習歸納的方法可以分析,有外接電源時鐵放在電源的正極,鐵被腐蝕的最快;若放在負極腐蝕的最慢;原電池中,兩極的金屬活動性差別越大,反應越快,但若有活動性強于鐵的金屬存在則鐵不被腐蝕(保護了鐵),所以此題的答案是:
(4)、(2)、(1)、(3)、(5)。
2.電解規(guī)律的應用
【設問】
電解規(guī)律的應用有什么內(nèi)容?
回答:
主要應用是:依據(jù)電解的基本原理分析判斷電解質(zhì)溶液。
【設問】
如何恢復電解液的濃度呢?(舉例說明)
回答:
電解液應先看pH的變化,再看電極產(chǎn)物。欲使電解液恢復一般是:
電解出什么物質(zhì)就應該加入什么,如:電解飽和食鹽水在溶液中減少的是氯氣和氫氣,所以應該加入的是氯化氫。</PGN0101.TXT/PGN>
【設問】
如果電解硫酸銅時,要恢復原來的濃度應該加入什么呢?
回答:
因為電解硫酸銅時,生成的是銅和氧氣,所以應該向溶液中加入氧化銅。
【設問】
電解在應用中還應該注意什么呢?
回答:
在分析應用問題中還應該注意:
一要:不僅考慮陰極、陽極放電的先后順序,還應該注意電極材料(特別是陽極)的影響;二要:熟悉用惰性電極電解各類電解質(zhì)溶液的規(guī)律。
【練習】
用石墨電極電解1mol/L的下列溶液,溶液的pH不變的是______。
(1)HCl (2)NaOH
(3)Na2SO4 (4)NaCl
回答:
鹽酸溶液電解產(chǎn)生氯氣和氫氣,溶液的pH升高。
氫氧化鈉溶液電解產(chǎn)生氫氣和氧氣,溶液的pH升高。
硫酸鈉溶液電解產(chǎn)生氫氣和氧氣,溶液的pH不變。
氯化鈉溶液電解產(chǎn)生氫氧化鈉、氫氣和氯氣,溶液的pH升高。
所以(1)、(2)、(4)溶液的pH都增大。
答案:pH不變的是(3)。
以上的四種溶液電解后,如何使其濃度恢復到原來的濃度呢?
回答:
在(1)中應該加入氯化氫。
在(2)中應該加入一定量的水。
在(3)中應該加入一定量的水。
在(4)中應該加入一定量的氯化氫。
3.綜合利用――實用電池與可逆電池
常見的電池應用是:
①干電池(Zn-Mn電池)
日常生活和照明。
②鉛蓄電池
應用于國防、科技、交通、化學電源等。
③鋰電池
密度小,壽命長應用于電腦、手表、心臟起搏器、火箭、導彈的電源。
④燃燒電池
污染小、能量轉(zhuǎn)化高,應用于高科技研究。
⑤其它電池
鋁電池:能量高、不污染環(huán)境應用于照明、野營作業(yè)。
回答:
應用在手電、心臟起搏器、海洋照明、航標電源。
今后我們還可以根據(jù)原理設計出更多更好的實用電池。
【投影】
例題1如圖2-17,E為沾有Na2SO4溶液的濾紙,并加入幾滴酚酞。A,B分別為Pt片,壓在濾紙兩端,R、S為電池的電極。M、N是用多微孔的Ni的電極材料,它在堿溶液中可以視為惰性電極。G為電流計,K為開關。C、D和電解池中都充滿濃KOH溶液。若在濾紙中央點上一滴紫色的KMnO4溶液,K打開,接通電源一段時間后,C、D中有氣體產(chǎn)生。
(1)外電源的正、負極分別是R為____,S為_____。
(2)A附近溶液的現(xiàn)象是_______,B附近發(fā)生的電極反應式為_____。
(3)濾紙上的紫色點向哪方移動____。
(4)當C、D里的氣體產(chǎn)生到一定量時,切斷外電源并接通開關K,經(jīng)過一段時間,C、D中氣體逐漸減少,主要因為____,有關的反應式為_____。
三、典型習題分析
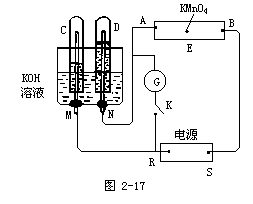
根據(jù)圖分析回答:
(1)C、D產(chǎn)生氣體的體積是不相同的,由此可以判斷C端的氣體是氫氣,D端產(chǎn)生的氣體是氧氣,所以確定R為負極而S端是正極。
(2)A附近的變化是變?yōu)榧t色,因為D端放氧氣,N端為陽極,而A端為陰極,吸引陽離子,陽離子放電2H+-2e=H2。因為,電解破壞了水的電離平衡,所以,此處OH-濃度增大,溶液顯紅色。而在B端發(fā)生OH-放電,其反應為:4OH--4e=2H2O+O2。
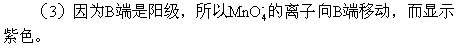
(4)氫氣和氧氣在堿的環(huán)境下發(fā)生的是電池反應,(類似燃燒電池),消耗了氫氣和氧氣。
(-)2H2+4OH--4e=4H2O
(+)O2+2H2O+4e=4OH-
【評價】此題是一道比較綜合的題,它考察了電化學知識的大部分內(nèi)容。
此題的突破點是,示意圖中的兩種氣體的體積,由此確定電源的正、負極,使題中所有問題迎刃而解。這位同學分析得非常好,我們應該認真的讀題,抓住題中的突破口。
【投影】
例題2 用石墨電極電解100mLH2SO4和CuSO4混合溶液,通電一段時間后,兩極各出現(xiàn)氣體
請同學們分析后給出答案。
回答:
陽極產(chǎn)生的氧氣為
由CuSO4電解時放出的氧氣為0.05mol,計算是:
2Cu2+~O2
2/y=1/0.05 y=0.1mol
c(Cu2+)=0.1/0.1=(mol/L)
【評價】
此題的突破口是根據(jù)題意分析出兩極各產(chǎn)生的氣體為
同學們的分析是非常正確的。
【投影】
例題3 人工生成鋁表面的氧化鋁保護膜的方法是將表面光潔的鋁制品作為陽極放入盛18%H2SO4溶液的電解槽。通電一定時間,設陽極氧氣全部與鋁反應。
思考后回答:
通過的電量為
今有表面積約1.0dm2的鋁制品,放入電解槽,通入
請同學們分析:
在從2molAl與1.5mol氧氣反應產(chǎn)生氧化鋁可知,得失電子為6mol。根據(jù)此反應計算出氧化鋁的物質(zhì)的量,再根據(jù)氧化鋁的密度和表面求出氧化膜的厚度。
此題的答案是:24μm(微米)。
【評價】
同學們分析的比較清楚,在作此題時應該抓住時間、表面積、電量、物質(zhì)的量的相互關系,應用數(shù)學方法得到正確的答案。
請同學們通過練習鞏固復習的知識,提高解題的能力,以適合生活、生產(chǎn)、科技的需要。
精選題
一、選擇題
1.銀鋅電池廣泛應用各種電子儀器的電源,它的充電和放電過程可以表示為:
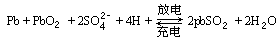
反應的物質(zhì)是 [ ]
A.Ag
B.Zn(OH)2
C.Ag2O
D.Zn
2.應用惰性電極插入500mLAgNO3溶液中,通電電解,當電解溶液的pH從6變?yōu)?時(設陰極沒有H2析出,電解前后的溶液體積不變),電極上析出銀的質(zhì)量是 [ ]
A.27mg
B.54mg
C.108mg
D.216mg
二、非選擇題
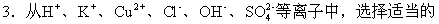
離子組成符合下列情況的電解質(zhì),進行電解(各離子只能使用一次)。
(1)以碳棒為電極進行電解,電解質(zhì)的含量減少,水量保持不變,兩極都有氣體生成,氣體體積相同,則該電解質(zhì)的化學式為____,電解的電極反應____,電解的總方程式是____。
(2)以鉑絲為電極進行電解,水量減少,電解質(zhì)的含量保持不變,兩極都有氣體生成,氣體體積為2∶1,則該電解質(zhì)的化學式為____,電極反應式為____。
(3)惰性電解,電解質(zhì)的含量減少,水的含量也減少,pH下降,則電解質(zhì)的化學式為____,電解總的方程式____。
4.正在研究應用鋅頂替鉛的電池,它可以減少環(huán)境污染容量又很大,其電池反應為2Zn+O2=ZnO,其原料為鋅和電解質(zhì)溶液、空氣。請寫出:
(1)電極反應____,____。
(2)估計該電解質(zhì)溶液應該用____(強的酸或強的堿)。
5.定溫下,將一定量飽和Na2SO4溶液用鉑電極通電電解。當陽極逸出amol氣體時,同時從溶液中析出mgNa2SO4?10H2O晶體,則原來飽和Na2SO4溶液的質(zhì)量分數(shù)是____。
6.某學生試圖用電解法根據(jù)電極上析出物質(zhì)的質(zhì)量來驗證阿伏加德羅常數(shù)值,其實驗方案的要點為:
①用直流電電解氯化銅溶液,所用儀器如圖2-18。
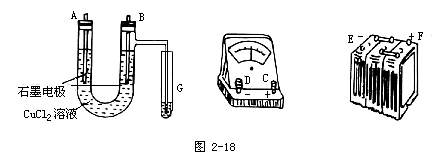
②在電流強度為IA,通電時間為ts后,精確測得某電極上析出的銅的質(zhì)量為mg。試回答:
(1)連接這些儀器的正確順序為(用圖中標注儀器接線柱的英文字母表示。下同)E接____,C接____,接F____。
實驗電路中的電流方向為____→____→____→C→____→____。
(2)寫出B電極上發(fā)生反應的離子方程式______。
G試管中淀粉KI溶液變化的現(xiàn)象為______,相應的離子方程式為______。
(3)為精確測定電極上析出銅的質(zhì)量,所必需的實驗步驟的先后順序是______。
①稱量電解前電極質(zhì)量
②刮下電解后電極上的銅并洗凈
③用蒸餾水清洗電解后電極
④低溫烘干電極后稱量
⑤低溫烘干刮下的銅后稱量
⑥再次低溫烘干后稱量至恒重
(4)已知電子電量為1.6×10
答 案
一、選擇題
1.D 2.B
二、非選擇題
3.(1)HCl 陽極:2Cl-―2e→Cl2↑陰極:2H++2e→H2↑
總反應式:2HCl  H2↑+Cl2↑
H2↑+Cl2↑
(2)KOH 陽極:4OH--4e→2H2O+O2↑陰極:4H++4e→2H2↑
(3)CuSO4總反應式:2CuSO4+2H2O  2Cu+2H2SO4+O2↑
2Cu+2H2SO4+O2↑
4.(1)負極:Zn―2e→Zn2+正極:O2+4e+2H2O→4OH-
(2)強堿
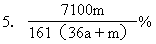
6.(1)D、A、B F→B→A→C→D→E
(2)2Cl-―2e=Cl2,變藍色,2I-+Cl2=I2+2Cl-
(3)①③④⑥
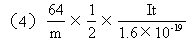
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com