
科目: 來源: 題型:
【題目】四氯化錫是一種無色有強烈的刺激性氣味的液體,有腐蝕性,常用作媒染劑和有機合成上的氯化催化劑。工業上常用氯氣與金屬錫或 SnCl2 來制得。某化學興趣小組把干燥氯氣通入熔融 SnCl2 2H2O中制取無水SnCl4有如圖所示的相關裝置:
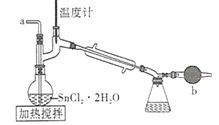
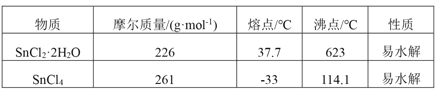
(1)盛裝SnCl4的容器應貼上的安全警示標簽是____________(填序號)。

(2)裝置b的作用是______________________ 。
(3)為避免 SnCl4 水解,通Cl2 前應先除 SnCl2 的結晶水,其操作是_____________,在潮濕空氣中 SnCl4 水解產生白色煙霧, 其化學方程式為 ________________ 。
(4)該學習小組最終制得的SnCl4 呈黃色,可能的原因是 ______________________,如果要除去黃色得到無色產品,你的做法是 ________________________。
(5)可以通過測定剩余SnCl4 的量來計算該次實驗的產率, 方法是讓殘留的SnCl4 與足量硫酸鐵銑反應,其中Fe3+被Sn2+還原為Fe2+。 然后在硫酸和磷酸混合條件下,以二苯胺磺酸鈉作指示劑,用 K2Cr2O7 標準溶液滴定生成的Fe2+過程中的離子方程式為
a.Sn2++2Fe3+=2Fe2++Sn4+
b.Cr2O72-+____Fe2++(______)____=_____Cr3++______Fe3++(_____)_____
①完成并配平上述方程式b。
②已知二苯胺磺酸鈉還原態為無色,氧化態為紫色,則滴定達到終點的現象是____
③若實驗前稱取 22.6g SnC12H2O晶體于燒瓶中,實驗結束后,向燒瓶內殘留物中通入足量N2,取燒瓶內殘留物溶于水配成250mL 溶液,取25mL于錐形瓶中,用以上方法滴定,消耗0.0l 00mol/L K2Cr2O7標準溶20.00mL, 則 SnCl4的產率最大值為__________ 。
查看答案和解析>>
科目: 來源: 題型:
【題目】磷、硫、氯、砷等是農藥中的重要組成元素。回答下列問題:
(1)基態砷原子的核外價電子排布式為_______________ 。
(2)生產農藥的原料 PSCl3 中 P、S、Cl 的第一電離能由大到小的順序為____電負性由大到小的順序為__________________________。
(3)H2SO4為粘稠狀 難揮發性的酸 ,而 HNO3 是易揮發的酸,其原因是__________
(4)COS(羰基硫)可用作糧食的熏蒸劑,其中碳原子的雜化軌道類型為________,所含共價 鍵的類型為_____________,N2O與CO2互為等電子體 ,且N2O 分子中O只與一個N相連,則N2O的電子式為_______________ 。
(5)AlP 因殺蟲效率高、廉價易得而被廣泛應用。已知AlP的熔點為2000℃ ,其晶胞結構如圖所示。

①磷化鋁的晶體類型為 _____________________ 。
②A、B 點的原子坐標如圖所示,則C點的原子坐標為 __________________ 。
③磷化鋁的晶胞參數a = 546.35 pm(l pm=10—12 m), 其密度為________g/cm3( 列出計算式即可,用NA表示阿伏加德羅常數的數值)。
查看答案和解析>>
科目: 來源: 題型:
【題目】X、Y、Z、W為短周期元素,它們在周期表中相對位置如圖所示。若Y原子的最外層電子是內層電子數的3倍,下列說法正確的是 ( )
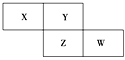
A. 原子半徑:W>Z>XB. 非金屬性:Z>Y
C. 最高化合價:X>ZD. 最高價氧化物對應水化物的酸性:W>Z
查看答案和解析>>
科目: 來源: 題型:
【題目】氯胺是一種長效緩釋水消毒劑,主要包括一氯胺、二氯胺和三氯胺(NH2Cl,NHCl2和NCl3)。工業上可利用NH3(g)+Cl2(g) ![]() NH2Cl(g)+HCl(g)制備一氯胺。回答下列問題:
NH2Cl(g)+HCl(g)制備一氯胺。回答下列問題:
(1)氯胺作飲用水消毒劑是因為水解生成具有強烈殺菌作用的物質,該物質是___,二氯胺與水反應的化學方程式為___。
(2)已知部分化學鍵的鍵能和化學反應的能量變化如表和如圖所示(忽略不同物質中同種化學鍵鍵能的細微差別)。
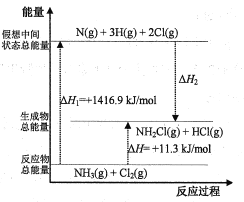
化學鍵 | N-H | N-Cl | H-Cl |
鍵能(kJ/mol) | 391.3 | x | 431.8 |
則ΔH2=___kJ/mol,x=___。
(3)在密閉容器中反應NH3(g)+Cl2(g) ![]() NH2Cl(g)+HCl(g)達到平衡,據此反應通過熱力學定律計算理論上NH2Cl的體積分數隨
NH2Cl(g)+HCl(g)達到平衡,據此反應通過熱力學定律計算理論上NH2Cl的體積分數隨![]() (氨氯比)的變化曲線如圖所示。
(氨氯比)的變化曲線如圖所示。
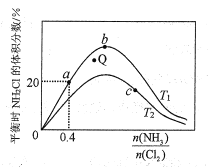
①a、b、c三點對應平衡常數的大小關系是___。T1溫度下該反應的平衡常數為___(列出算式即可)。
②在T2溫度下,Q點對應的速率:v正___v逆(填“大于”“小于”或“等于”)。
③在氨氯比一定時,提高NH3的轉化率的方法是___(任寫1種)
④若產物都是氣體,實驗測得NH2Cl的體積分數始終比理論值低,原因可能是___。
查看答案和解析>>
科目: 來源: 題型:
【題目】一定溫度下用過量鐵塊與稀硫酸反應制取氫氣,采取下列措施:①將鐵塊換為等質量的鐵粉;②加入少量![]() 溶液;③加入少量
溶液;③加入少量![]() 固體;④加入少量水;⑤加熱⑥將稀硫酸換為
固體;④加入少量水;⑤加熱⑥將稀硫酸換為![]() 的硫酸,其中可提高
的硫酸,其中可提高![]() 的生成速率的措施有
的生成速率的措施有
A.①③④B.①③⑤C.②④⑤D.②⑤⑥
查看答案和解析>>
科目: 來源: 題型:
【題目】如圖是Zn和Cu組成的原電池示意圖,某小組做完該實驗后,在讀書卡片上作了如下記錄,其中合理的是 ( )
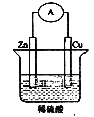
實驗記錄:①導線中電流方向:鋅→銅②銅極上有氣泡產生③鋅片變薄
實驗結論:④Zn為正極,Cu為負極⑤銅比鋅活潑⑥H+向銅片移動
A.①②③B.④⑤⑥C.③④⑤D.②③⑥
查看答案和解析>>
科目: 來源: 題型:
【題目】常溫下,向1L0.1 molL—l 一元酸HR溶液中逐漸通入氨氣[已知常溫下NH3 H2O電離平衡常數K = l .76x 10-5], 使溶液溫度和體積保持不變, 混合溶液的pH與離子濃度變化的關系如圖所示。下列敘述正確的是
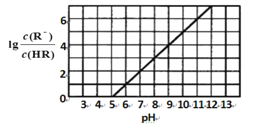
A.0. l molL—1HR 溶液的pH為5
B.HR為弱酸,常溫時隨著氨氣的通入,c(R—)/[c(OH—).c(HR)] 逐漸增大
C.當通入0.1 mol NH3時,c(NH4+ > c(R—)
D.當c(R— )=c(HR)時 溶液必為中性
查看答案和解析>>
科目: 來源: 題型:
【題目】電解原理在化學工業中有廣泛應用。如圖表示一個電解池,裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連。請回答以下問題:
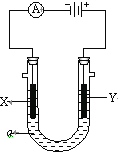
(1)若X、Y都是惰性電極,a是飽和NaCl溶液,實驗開始時,同時在兩邊各滴入幾滴酚酞試液,則:
①Y電極上的電極反應式為___;在X極附近觀察到的實驗現象是___;
②電解總反應的離子方程式:____。
(2)如要用電解方法精煉粗銅,電解液a選用CuSO4溶液,則
①X電極的材料是___;電極反應式是___。
②Y電極的材料是___;電極反應式是___。
(說明:雜質發生的電極反應不必寫出)
查看答案和解析>>
科目: 來源: 題型:
【題目】如圖設計的串聯電池裝置,R為變阻器,以調節電路電流。
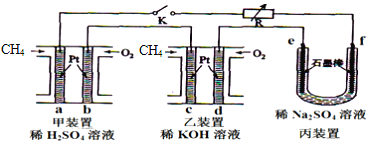
(1)寫出b、c電極的電極反應式:b___,c___;
(2)寫出f電極的電極反應式___,向此電極區域滴入酚酞的現象為:___;該電極區域水的電離平衡被___(填“促進”、“抑制”或“無影響”)。
(3)閉合K一段時間后,丙裝置的電解質溶液pH___(填“變大”、“變小”或“不變”),原因是___。
(4)電解一段時間后丙裝置析出芒硝(Na2SO410H2O),若此時通入CH4的體積為22.4L(標準狀況下),則向丙裝置中加入___gH2O就可以將析出的沉淀溶解并恢復到原有濃度。
(5)有一硝酸鹽晶體,其化學式為M(NO3)xyH2O,相對分子質量為242。取1.21g該晶體溶于水,配成100mL溶液,將此溶液用石墨作電極進行電解,當有0.0100mol電子發生轉移時,溶液中金屬全部析出。經稱量陰極增重0.320g。則
①金屬M的相對原子質量為___;
②電解后,生成氣體體積=___(標準狀況下)溶液的pH=___(電解過程中溶液體積變化忽略不計)。要求寫出計算過程。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com