
科目: 來源: 題型:
【題目】根據當地資源等情況,硫酸工業常用黃鐵礦(主要成分為FeS2)作為原料。完成下列填空:
(1)將0.050mol SO2(g) 和0.030mol O2(g) 充入一個2L的密閉容器中,在一定條件下發生反應:2SO2(g)+O2(g)![]() 2SO3(g)+Q 。經2分鐘反應達到平衡,測得n(SO3) = 0.040mol,則O2的平均反應速率為______________________。
2SO3(g)+Q 。經2分鐘反應達到平衡,測得n(SO3) = 0.040mol,則O2的平均反應速率為______________________。
(2)在容積不變時,下列措施中有利于提高SO2平衡轉化率的有________(選填編號)。
a.移出氧氣
b.降低溫度
c.減小壓強
d.再充入0.050molSO2(g)和0.030molO2(g)
(3)在起始溫度T1(673K)時SO2的轉化率隨反應時間(t)的變化如圖。請在圖中畫出其他條件不變情況下,起始溫度為T2(723K)時SO2的轉化率隨反應時間變化的示意圖。________。

查看答案和解析>>
科目: 來源: 題型:
【題目】以烯烴為原料可以合成多種高聚物的合成路線如下:
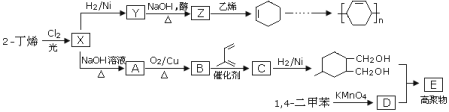
已知:烯烴和X2在一定條件下能發生取代,且能發生雙烯合成如![]() 。
。
請回答下列問題:
(1)X中含有的官能團為_____________________________________;
(2)Y→Z的化學方程式為_____________________________;
(3)高聚物E的結構簡式為____________________________;甲是A的一種同分異構體,其能實現轉化:![]() ,甲的名稱為________;
,甲的名稱為________;
(4)由![]() 可以合成
可以合成![]() 。按合成路線的順序,涉及反應的反應類型有:______________。
。按合成路線的順序,涉及反應的反應類型有:______________。
查看答案和解析>>
科目: 來源: 題型:
【題目】立方烷衍生物I的合成路線如圖:
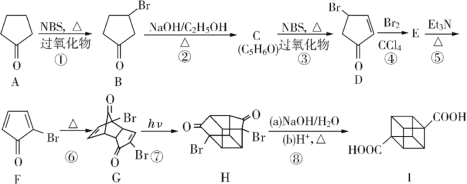
請回答下列問題:
(1)C的結構簡式為____________,E的結構簡式為__________。
(2)③的反應類型為____________,⑤的反應類型為__________。
(3)已知A由下述三步反應,其中第3步反應試劑和條件為O2/Cu,△。
![]()
請寫出反應1的試劑和條件:___________,反應2的化學方程式為_______________________。
(4)在該合成路線中的化合物(A~I),其中互為同分異構體的是_____________(填字母代號)
(5)化合物I的核磁共振氫譜共有____組峰,峰面積之比為____________。
(6)第⑥步反應的名稱為D-A反應,理解其中成鍵與斷鍵關系,請寫出由乙炔為原料合成1,4-環己二烯流程。(無機試劑、溶劑任選)_______________
(7)寫出以![]() 和
和![]() 為原料,制備醫藥中間體
為原料,制備醫藥中間體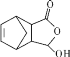 的合成路線(無機試劑、溶劑任選)___________
的合成路線(無機試劑、溶劑任選)___________
查看答案和解析>>
科目: 來源: 題型:
【題目】硝酸銅是重要的化工原料,以下三種方法均可得到硝酸銅。
已知:2NO2+2NaOH=NaNO3+ NaNO2+H2O ,NO+NO2+2NaOH=2NaNO2+H2O(以下涉及到的氣體體積均為標準狀況下數據):
(1)甲組用a克Cu粉,在加熱的條件下,與空氣充分反應,然后將生成的CuO全部溶于VmL稀硝酸中,制得硝酸銅溶液,則所需稀硝酸的濃度至少為_______mol/L,需要質量分數為ω%,密度為ρg/cm3的濃硝酸_______mL(均用最簡分式表示)。
(2)乙組用b克Cu粉,全部溶于過量的稀硝酸中,溶液質量增重_____克,將生成的氣體通入足量NaOH溶液中并同時通入氧氣的體積至少_______L才能使生成的氣體吸收完全(均用最簡分式表示)。
(3)丙組取某稀硫酸和稀硝酸的混合溶液200 mL,平均分成兩份。向其中一份中逐漸加入銅粉,最多能溶解9.6 g。向另一份中逐漸加入鐵粉,產生氣體的量隨鐵粉質量增加的變化如圖所示(已知硝酸只被還原為NO氣體)。列式計算原混合酸中硝酸的物質的量是多少?____________硫酸的物質的量濃度多少?_________
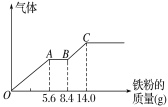
查看答案和解析>>
科目: 來源: 題型:
【題目】利用下圖裝置進行乙醇的催化氧化實驗并制取乙醛(試管丙中用水吸收產物)。請填寫下列空白:

(1)檢驗乙醛的試劑是_________;(選填編號)
a.銀氨溶液 b.碳酸氫鈉溶液 c.新制氫氧化銅 d.氧化銅
(2)乙醇發生催化氧化的化學反應方程式為____________;
(3)實驗開始時,是先鼓入空氣還是先點燃酒精燈加熱銅絲?_____________,原因是_________;該實驗中“鼓氣速度”這一變量你認為可用______來估量;
(4)實驗時,常常將甲裝置浸在70℃~80℃的水浴中,目的是_______。以下實驗需要水浴加熱的是_________;(選填編號)
a.鹵代烴水解 b.銀鏡反應 c. 乙酸丁酯 d.苯的硝化反應
(5)該課外活動小組偶然發現向溴水中加入乙醛溶液,溴水褪色(假設兩者恰好完全反應)。該同學為解釋上述現象,提出兩種猜想:① 溴水將乙醛氧化為乙酸;② 溴水與乙醛發生加成反應。請你設計一個簡單的實驗,探究哪一種猜想正確?__________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】CuSO4 5H2O是銅的重要化合物,有著廣泛的應用。
(一)CuSO4·5H2O制取
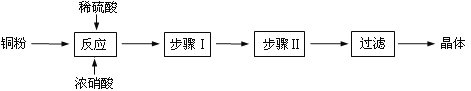
完成下列填空:
(1)向含銅粉的稀硫酸中滴加少量濃硝酸(可加熱),銅粉溶解時可以觀察到的實驗現象:_____。
(2)根據反應原理,硝酸與硫酸的理論配比(物質的量之比)為______________________。
(3)步驟Ⅰ______________;步驟Ⅱ______________。
(二)膽礬中CuSO4·5H2O含量的測定
已知:CuSO4 + 2NaOH → Cu(OH)2 ↓+ Na2SO4
(1)實驗方案如下,并將步驟④補全:
①將12.500g膽礬樣品溶解,配成100mL溶液,取25mL于燒杯中;
②向溶液中加入100mL0.2500mol/L氫氧化鈉溶液使Cu2+完全沉淀(不考慮其它副反應);
③過濾,多余的氫氧化鈉溶液用0.5000mol/L鹽酸滴定至終點,耗用10.00mL鹽酸;
④___________________________
⑤數據處理。
(2)在滴定中,眼睛應注視__________;滴定終點時,準確讀數應該是滴定管上________所對應的刻度。
(3)就方案中數據進行處理,則樣品CuSO4·5H2O中質量分數為___________。步驟③中沉淀未洗滌,導致結果______(填偏大、偏小、無影響)。
查看答案和解析>>
科目: 來源: 題型:
【題目】一定條件下,在水溶液中1 mol Cl-、ClO![]() (x=1,2,3,4)的能量(kJ)相對大小如圖所示。D是____(填離子符號)。B→A+C的熱化學方程式為____________(用離子符號表示)。
(x=1,2,3,4)的能量(kJ)相對大小如圖所示。D是____(填離子符號)。B→A+C的熱化學方程式為____________(用離子符號表示)。
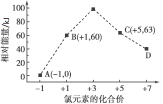
查看答案和解析>>
科目: 來源: 題型:
【題目】氯的氧化物是氯與氧的二元化合物的總稱,也稱為氧化氯。目前Cl2O、ClO2、Cl2O7已能制取。
有關數據見下表:
化學式 | Cl2O | ClO2 | Cl2O7 |
相對分子質量 | 87 | 67.5 | 183 |
沸點/℃ | 2 | 9.7 | 81 |
完成下列填空:
(1)Cl2O是____ 酸的酸酐,Cl2O電子式為____________。
(2)下列能判斷Cl和O兩種元素非金屬性強弱的是______(選填編號)。
a.氧化氯的分子式 b.與金屬反應得電子的數目
c.氣態氫化物的穩定性 d.最高價氧化物對應水化物的酸性
(3)根據分子間作用力對沸點影響的變化規律:組成和結構相似的分子,其沸點隨著相對分子質量的增大而升高,但上表中相對分子質量是Cl2O7>Cl2O>ClO2,其沸點的變化不是Cl2O7>Cl2O>ClO2的原因是___________________________。
(4)ClO2和堿溶液反應生成亞氯酸鹽(陰離子是ClO2-)和氯酸鹽,其離子方程式是________,氧化產物________。(填離子符號)
查看答案和解析>>
科目: 來源: 題型:
【題目】2015年諾貝爾獎獲得者屠呦呦提取的抗瘧新藥青蒿素的結構簡式,用鍵線式表示如圖。
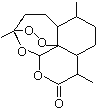
(1)青蒿素的分子式為________________________。
(2)為了引入過氧基![]() ,需要在有機合成中引入羥基,引入羥基的反應類型有_____。(選填編號)
,需要在有機合成中引入羥基,引入羥基的反應類型有_____。(選填編號)
①取代 ②加成 ③消去 ④酯化 ⑤還原
(3)天然香草醛(![]() )可用于合成青蒿素,合成天然香草醛的反應如下:
)可用于合成青蒿素,合成天然香草醛的反應如下:
![]()
(4)步驟①③的作用是_________________________________________________________________________________。
(5)C8H10O3的結構簡式:__________________________________________________________。
(6)C與這種天然香草醛互為同分異構體,寫出符合下列條件的C的一種結構簡式_________________。
①有苯環;②能水解;③能發生銀鏡反應;④遇FeCl3溶液發生顯色反應。
(7)芐基乙醛![]() 是合成青蒿素的中間原料之一,寫出由苯甲醛和氯乙烷為原料,制備芐基乙醛的合成路線流程圖(無機試劑任用)。____________________
是合成青蒿素的中間原料之一,寫出由苯甲醛和氯乙烷為原料,制備芐基乙醛的合成路線流程圖(無機試劑任用)。____________________
已知:羰基α-H可發生反應:
![]()
查看答案和解析>>
科目: 來源: 題型:
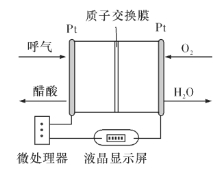
【題目】利用反應6NO2+8NH3=7N2+12H2O構成電池的方法,既能實現有效除氮氧化物的排放,減輕環境污染,又能充分利用化學能,裝置如圖所示,回答問題:
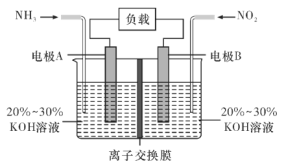
(1)電流從____(選填“左”或“右”,下同)側電極經過負載后流向______側電極。
(2)為使電池持續放電,離子交換膜需選用______離子交換膜(選填“陰”或“陽”)。
(3)A電極上的電極反應式為___________________________。
(4)當有4.48 L NO2(標準狀況)被處理時,轉移電子為________摩爾。
(5)負載可以測定電流大小,從而確定氣體含量,酒駕測定工作原理與其相似。仔細閱讀圖:寫出酒駕測定中電池總反應方程式:______________________________,負極反應方程式:____________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com