
科目: 來源: 題型:
【題目】一定溫度下將Cl2緩慢通入水中。當通入的Cl2體積為V1時達到飽和,溶液中c(H+)變化如圖中曲線a。已知Cl2的溶解度隨溫度升高而迅速降低,下列敘述中正確的是( )
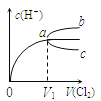
A.將飽和氯水加水稀釋,溶液中c(H+)變化如曲線b
B.將飽和氯水降低溫度,溶液中c(H+)變化如曲線c
C.在飽和氯水中加入NaOH使pH>7,所得溶液中存在下列關系:c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(ClO-)
D.在飽和氯水中加入NaOH使pH=7,所得溶液中存在下列關系:c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
查看答案和解析>>
科目: 來源: 題型:
【題目】一定條件下,在體積為10L的密閉容器中,1molX和1molY進行反應:2X(g)+Y(g)![]() Z(g),經60s達到平衡,生成0.3molZ,下列說法正確的是( )
Z(g),經60s達到平衡,生成0.3molZ,下列說法正確的是( )
A.將容器體積變為20L,Z的平衡濃度變為原來的一半
B.若增大壓強,則物質Y的轉化率減小
C.若升高溫度,X的體積分數增大,則該反應的△H>0
D.以X濃度變化表示的反應速率為0.001mol/(L·s)
查看答案和解析>>
科目: 來源: 題型:
【題目】下列實驗與對應的圖象不符合的是( )
A.①向一定體積的氫氧化鈉溶液中逐滴加入稀鹽酸溶液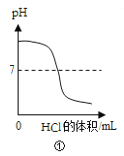
B.②將鎂片和鐵片(均足量)分別和等質量、等溶質質量分數的稀硫酸混合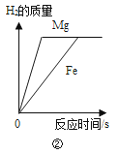
C.③是對于達到平衡狀態的N2(g)+3H2(g)![]() 2NH3(g)反應,在t1時縮小容器體積
2NH3(g)反應,在t1時縮小容器體積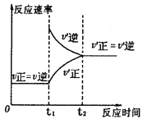
D.④是將pH=2的鹽酸和醋酸分別加水稀釋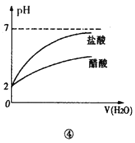
查看答案和解析>>
科目: 來源: 題型:
【題目】室溫下進行的下列實驗,不能達到預期目的的是( )
序號 | 實驗內容 | 實驗目的 |
A | 測定NaClO溶液、CH3COONa溶液的pH | 比較HClO和CH3COOH的酸性強弱 |
B | 向Mg(OH)2濁液中滴加少量0.1mol/LFeCl3溶液 | 比較Mg(OH)2和Fe(OH)3的溶解度 |
C | 將兩個完全相同且充滿NO2的密閉燒瓶,分別浸泡于熱水、冰水中 | 探究溫度對該化學平衡狀態的影響 |
D | 向兩只同體積同濃度的K2Cr2O7溶液中,分別加入1mL同濃度的H2SO4、NaOH溶液 | 探究濃度對該化學平衡狀態的影響 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 來源: 題型:
【題目】以鉻鐵礦[主要成份為Fe(CrO2)2,含有Al2O3、Fe2O3、SiO2等雜質]為主要原料生產重鉻酸鈉晶體(Na2Cr2O7·2H2O)的主要工藝流程如圖:
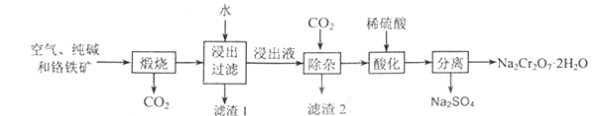
(1)煅燒過程中,鉻鐵礦中的Al2O3與純堿反應的化學方程式為:____。
(2)濾渣1的成分為_____,濾渣2的成分為_____。
(3)該工藝中某種產物可以再利用,該物質的化學式為:_____。
(4)酸化時發生的反應為:2CrO42-+2H+![]() Cr2O72-+H2O,若1L酸化后所得溶液中含鉻元素的質量為28.6g,CrO42-有
Cr2O72-+H2O,若1L酸化后所得溶液中含鉻元素的質量為28.6g,CrO42-有![]() 轉化為Cr2O72-。
轉化為Cr2O72-。
①酸化時發生反應的平衡常數的表達式為K=_____。
②酸化后所得溶液中c(Cr2O72-)=____。
(3)根據有關國家標準,含CrO42-的廢水要經化學處理,使其濃度降至5.0×10-7mol·L-1以下才能排放。含CrO42-的廢水處理通常有以下兩種方法。
①沉淀法:加入可溶性鋇鹽生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸鹽處理多余的Ba2+。加入可溶性鋇鹽后的廢水中Ba2+的濃度應不小于____mol·L-1,后續廢水處理方能達到國家排放標準。
②還原法:CrO42-![]() Cr3+
Cr3+![]() Cr(OH)3。寫出酸性條件下CrO42-與綠礬反應的離子方程式____。
Cr(OH)3。寫出酸性條件下CrO42-與綠礬反應的離子方程式____。
查看答案和解析>>
科目: 來源: 題型:
【題目】某同學設計如圖裝置制取少量溴苯,請回答下列問題:
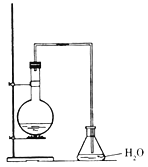
(1)寫出實驗室制取溴苯的化學方程式:___。
(2)上述反應發生后,在錐形瓶中加入硝酸銀溶液觀察到的現象是___,這一現象能否說明溴和苯發生了取代反應(填“能”或“不能”)___,理由是___。
(3)反應后得到的溴苯中溶有少量苯、溴、三溴苯、溴化鐵和溴化氫等雜質,欲除去上述雜質,得到無水溴苯的合理實驗操作步驟可設計為(分液操作已略去):①水洗②堿洗③水洗④干燥⑤蒸餾。則上述操作②堿洗的主要目的是(填序號)___。
A.除三溴苯和溴化氫 B.除溴化鐵和三溴苯
C.除溴和溴化氫 D.除苯和溴
查看答案和解析>>
科目: 來源: 題型:
【題目】聚合硫酸鐵簡稱聚鐵[Fe2(OH)n(SO4)(3-0.5n)]m(n>2,m≤10),是一種高效的無機高分子混凝劑、凈水劑。實驗室利用硫酸亞鐵制取聚合硫酸鐵的主要流程如圖:

(1)FeSO4溶液顯弱酸性的原因是_____(用離子方程式表示)。
(2)加入濃硫酸調節pH的作用是:①_____;②_____。
(3)寫出加入H2O2發生反應的離子方程式:_____。
(4)測定聚鐵中含鐵量的方法為把聚鐵溶于過量酸中,先用過量的SnCl2將Fe3+還原成Fe2+,再加入HgCl2溶液除去過量的SnCl2,然后用標準的K2Cr2O7溶液(先加入幾滴試亞鐵靈指示劑)滴定溶液中的Fe2+。此過程發生的部分反應為:Sn2++2Hg2++8Cl-=Hg2Cl2↓+SnCl6,Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。
①用HgCl2除去過量的SnCl2的目的是_____。
②稱取聚鐵質量為10.00g配成100.0mL溶液,取出20.00mL,經上述方法處理后,用0.1000mol·L-1K2Cr2O7標準溶液滴定。達到終點時,消耗K2Cr2O7標準溶液12.80mL。則聚鐵中鐵元素的質量分數為_____%。
(5)某高效凈水劑是由K2FeO4得到的,工業上以硫酸鐵溶液、次氯酸鉀和氫氧化鉀為原料制備K2FeO4,該反應的化學方程式是_____。
查看答案和解析>>
科目: 來源: 題型:
【題目】(1)氫氧化鐵受熱分解化學方程式:___。
(2)Al(OH)3與NaOH溶液反應的離子方程式:___。
(3)鐵溶于鹽酸的離子方程式:___。
(4)Na2O2與CO2反應的化學方程式:___。
(5)乙烯的結構式:___。
(6)乙烯的電子式:___。
(7)Na2O2的電子式:___。
查看答案和解析>>
科目: 來源: 題型:
【題目】(1)有機物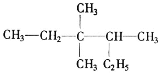 的名稱為__。
的名稱為__。
(2)已知某有機物的分子式為C3H8O,紅外光譜和核磁共振氫譜如圖,氫譜三個峰的面積之比分別為1∶1∶6,寫出其結構簡式___。
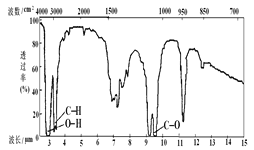
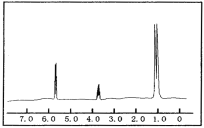
(3)0.2mol某烴A在氧氣中完全燃燒后,生成CO2和H2O各1.2mol。試回答:
①烴A的分子式為__。
②若烴A不能使溴水褪色,但在一定條件下能與氯氣發生取代反應,其一氯取代物只有一種,則烴A的結構簡式為__。
③若烴A能使溴水褪色,在催化劑作用下,與H2加成,其加成產物經測定分子中含有4個甲基,烴A可能有的結構簡式為___,___。(任寫2種)
查看答案和解析>>
科目: 來源: 題型:
【題目】溫度相同,向甲、乙兩體積相同的密閉容器中,各通入2mol SO2和1 mol O2發生反應;
2SO2(g)+O2(g) ![]() 2SO3(g)達到平衡時,甲容器中SO2的轉化率大于乙容器中SO2的轉化率。下列判斷正確的是 ( )
2SO3(g)達到平衡時,甲容器中SO2的轉化率大于乙容器中SO2的轉化率。下列判斷正確的是 ( )
A.甲保持壓強不變,乙保持體積不變
B.甲保持體積不變,乙保持壓強不變
C.混合氣體密度甲小于乙
D.混合氣體的平均相對分子質量甲小于乙
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com