
【題目】銅和濃硫酸發生反應的化學方程式為:Cu +2H2SO4(濃)![]() CuSO4+SO2↑+2H2O,其中硫元素被________(填“氧化”或“還原”,下同),發生__________反應;濃H2SO4作_______劑,具有___________性。在該反應中,若消耗了32gCu,則轉移了_______mol 電子 。
CuSO4+SO2↑+2H2O,其中硫元素被________(填“氧化”或“還原”,下同),發生__________反應;濃H2SO4作_______劑,具有___________性。在該反應中,若消耗了32gCu,則轉移了_______mol 電子 。
 智慧小復習系列答案
智慧小復習系列答案科目:高中化學 來源: 題型:
【題目】H2S廢氣資源化利用途徑之一是回收能量并得到單質硫.反應原理為:2H2S(g)+O2(g)═S2(s)+2H2O(l)△H=﹣632kJmol﹣1 . 如圖為質子膜H2S燃料電池的示意圖.下列說法正確的是( ) 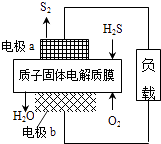
A.電極a為電池的正極
B.電極b上發生的電極反應為:O2+2H2O+4e﹣=4 OH﹣
C.電路中每流過4mol電子,電池內部釋放632kJ熱能
D.每17gH2S參與反應,有1mol H+經質子膜進入正極區
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述中通常不能作為判斷兩元素非金屬性強弱的依據是( )
A.氣態氫化物穩定性強弱B.元素氧化性強弱
C.最高價氧化物對應水化物的酸性強弱D.單質熔點高低
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整個過程中含碘物質的物質的量與所加入KBrO3的物質的量的關系如圖所示.
已知①BrO3﹣+6I﹣+6H+═3I2+Br﹣+3H2O;②2BrO3﹣+I2═2IO3﹣+Br2;
請回答下列問題:
(1)由反應②有同學由此得出氧化性:I2>Br2的結論,你認為是否正確(填是或否),并說明理由 .
(2)b點時,KI反應完全,則消耗的氧化劑與還原劑物質的量之比為 , 還原產物是 .
(3)b→c過程中只有一種元素的化合價發生變化,寫出該過程的離子反應方程式 .
(4)含6mol KI的硫酸溶液所能消耗n(KBrO3)的最大值為 mol.
(5)n(KBrO3)=4時,對應含碘物質的化學式為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式書寫正確的是( )
A.等體積等物質的量濃度的氫氧化鋇溶液與碳酸氫銨溶液混合:Ba2++2OH﹣+NH4++HCO3﹣=BaCO3↓+NH3H2O+H2O
B.氯化鋁溶液中加入過量的氨水:Al3++4 NH3H2O=4NH4++AlO2﹣+2H2O
C.向次氯酸鈣溶液中通入少量的二氧化硫:Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO
D.碳酸鈉溶液中加入過量的苯酚: ![]() +CO32﹣=
+CO32﹣= ![]() +HCO3﹣
+HCO3﹣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X,Y,Z,W均為短周期元素,它們在周期表的位置如圖所示,若W原子的最外層電子數是內層電子總數的 ![]() ,下列說法中正確的是( )
,下列說法中正確的是( ) ![]()
A.陰離子的半徑從大到小排列順序為:X>Y>Z>W
B.X元素的氫化物分子間可以形成氫鍵
C.Y的兩種同素異形體在常溫下可以相互轉化
D.最高價氧化物對應的水化物的酸性:W>Z
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關化學現象和化學概念表述正確的是
A. 0.5molFe和含1 mol HNO3的稀溶液充分反應后,滴入KSCN溶液,溶液變紅
B. Fe(OH)3膠體做電泳實驗時,由陰極區紅色加深可知Fe(OH)3膠體帶正電荷
C. 含有143個中子的U(92號)原子的原子符號: ![]() U
U
D. 1mol H3PO3最多可與2 mol NaOH發生中和反應,因此Na2HPO3屬于正鹽
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硝酰氯(NOCl,熔點:-64.5 ℃,沸點:-5.5 ℃)是一種黃色氣體,遇水易水解。可用于合成清潔劑、觸媒劑及中間體等。實驗室可由氯氣與一氧化氮在常溫常壓下合成。
(1)甲組的同學擬制備原料氣NO和Cl2,制備裝置如下圖所示:

為制備純凈干燥的氣體,下表中缺少的藥品是:
裝置Ⅰ | 裝置Ⅱ | ||
燒瓶中 | 分液漏斗中 | ||
制備純凈Cl2 | MnO2 | ①___ | ②___ |
制備純凈NO | Cu | ③___ | ④___ |
(2)乙組同學利用甲組制得的NO和Cl2制備NOCl,裝置如圖所示:

①裝置連接順序為a→________(按氣流自左向右方向,用小寫字母表示)。
②裝置Ⅳ、Ⅴ除可進一步干燥NO、Cl2外,另一個作用是____________。
③裝置Ⅶ的作用是____________。
④裝置Ⅷ中吸收尾氣時,NOCl發生反應的化學方程式為________________。
(3)丙組同學查閱資料,查得王水是濃硝酸與濃鹽酸的混酸,一定條件下該混酸可生成亞硝酰氯和氯氣, 該反應的化學方程式為__________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com