
【題目】物質結構決定性質,新材料的不斷涌現有力地促進了社會進步,因此了解物質結構具有重要意義。試回答下列問題:
(1)基態鐵原子中未成對電子數為_________,在水溶液中常以Fe2+、Fe3+的形式存在,其中________更穩定。
(2)OF2中氧元素的化合價為____,中心原子的雜化方式為___,OF2的分子極性比H2O的__________(選填“大”或“小”)。
(3)一種新型鋁離子電池中的電解質溶液由某種有機陽離子與AlCl4﹣、Al2Cl7﹣構成,AlCl4﹣的立體構型為_________,Al2Cl7﹣中的原子都是8電子結構,則Al2Cl7﹣的結構式為(配位鍵用“→”表示)__________。
(4)FeO晶體與NaCl晶體結構相似,要比較FeO與NaCl的晶格能大小,還需要知道的數據是___________;
(5)氮化鋁、氮化硼、氮化鎵晶體的結構與金剛石相似,它們晶體的熔點由高到低的順序是___________。
(6)NH3分子中∠HNH鍵角為106.7,而配離子[Zn(NH3)6]2+中∠HNH鍵角為109.5, 配離子[Zn(NH3)6]2+中∠HNH鍵角變大的原因是_____。
(7)下圖是Fe3O4晶體的晶胞。

①晶胞中亞鐵離子處于氧離子圍成的______(選填“正方形”、“正四面體”或“正八面體”)空隙。
②晶胞中氧離子的堆積方式的名稱為________。
③若晶胞的體對角線長為 a nm,則 Fe3O4 晶體的密度為________g/cm3(阿伏加德羅常數用 NA 表示)。
【答案】 4 Fe3+ +2 sp3 小 正四面體 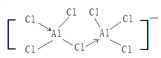 離子半徑大小 氮化硼>氮化鋁>氮化鎵 NH3分子中N原子的孤電子對進入Zn2+的空軌道形成配離子后,原孤電子對與N-H鍵的成鍵電子對間的排斥作用變為成鍵電子對之間的排斥,排斥作用減弱 正四面體 面心立方最密堆積
離子半徑大小 氮化硼>氮化鋁>氮化鎵 NH3分子中N原子的孤電子對進入Zn2+的空軌道形成配離子后,原孤電子對與N-H鍵的成鍵電子對間的排斥作用變為成鍵電子對之間的排斥,排斥作用減弱 正四面體 面心立方最密堆積 ![]()
【解析】試題分析:(1)根據電子排布式或軌道表示式進行判斷。(2)根據元素的非金屬性和電負性以及價層電子對互斥理論進行判斷。(3)根據價層電子對互斥理論進行判斷。(4)影響晶格能的因素有配位數、離子半徑和離子電荷。(5)原子半徑越小,原子晶體中共價鍵的鍵長越短,則共價鍵越強,晶體的熔點越高。(6)根據價層電子對互斥理論進行解釋。(7)根據配位數判斷堆積方式,根據晶胞的質量和體積求晶體的密度。
(1)基態鐵原子的電子排布式為[Ar]3d64s2,根據洪特規則和泡利不相容原理,3d軌道的6個電子要占據其全部5個軌道,故其中未成對電子數為4。鐵在水溶液中常以Fe2+、Fe3+的形式存在,其中基態Fe3+電子排布式為[Ar]3d5,其3d軌道為較穩定的半充滿狀態,故其更穩定。
(2)F是非金屬性最強的元素,其最外層有7個電子,故OF2中氧元素的化合價為+2,中心原子O的價層電子對數是4,故其雜化方式為sp3。OF2和H2O的分子空間構型相似,O與F之間的電負性的差值小于H和O的電負性差值,故OF2的分子極性比H2O的小。
(3)AlCl4﹣的中心原子的價層電子對數為4,故其立體構型為正四面體,Al2Cl7﹣中的原子都是8電子結構,則可知Al2Cl7﹣的Al原子各形成了一個配位鍵,其結構式為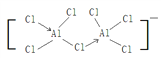 。
。
(4)FeO晶體與NaCl晶體結構相似,影響晶格能大小的因素有配位數、離子半徑和離子電荷,故要比較FeO與NaCl的晶格能大小,還需要知道的數據是離子半徑大小;
(5)氮化鋁、氮化硼、氮化鎵晶體的結構與金剛石相似,都是原子晶體,它們晶體的熔點由其共價鍵的鍵長決定,鍵長越短則共價鍵越強,其熔點越高,因為B、Al、Ga的原子半徑依次增大,故熔點由高到低的順序是氮化硼>氮化鋁>氮化鎵。
(6)NH3分子中∠HNH鍵角為106.7,而配離子[Zn(NH3)6]2+中∠HNH鍵角為109.5, 由價層電子對互斥理論可知,配離子[Zn(NH3)6]2+中∠HNH鍵角變大的原因是:NH3分子中N原子的孤電子對進入Zn2+的空軌道形成配離子后,原孤電子對與N-H鍵的成鍵電子對間的排斥作用變為成鍵電子對之間的排斥,排斥作用減弱。
(7)①由Fe3O4晶體的晶胞結構示意圖可知,晶胞中亞鐵離子處于氧離子圍成的正四面體空隙。
②晶胞中與每氧離子最近且等距的氧離子有12個,故其堆積方式為面心立方最密堆積。
③根據均攤法,由Fe3O4晶體的晶胞結構示意圖可以求出該晶胞中氧離子、鐵離子和亞鐵離子分別有4、2、1個,故每個晶胞中只有一個Fe3O4。晶胞的體對角線長為 a nm,則晶胞的邊長為![]() ,故NA個晶胞的質量和體積分別是232g和
,故NA個晶胞的質量和體積分別是232g和![]() ,則 Fe3O4 晶體的密度為
,則 Fe3O4 晶體的密度為![]() g/cm3。
g/cm3。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】X、Y、Z、W是原子序數依次增大的4種短周期主族元素,X、W均為所在周期數和族序數相等的元素,Y、Z易形成元素質量比為7:8和7:16的兩種常見化合物。下列說法正確的是
A. 原子半徑:Y<Z<W
B. 原子最外層電子數:W>Z>Y
C. X、Y可以形成具有極性鍵也有非極性鍵的化合物
D. 由X、Y、Z三種元素形成的化合物的水溶液一定顯酸性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F、G均為常見短周期元素,原子序數依次遞增。已知A、B、C能分別與D 組成二元化合物K、L、M,甲、乙分別是B、D的單質,常溫下分別是常見的固體和氣體,化合物M是產生光化學煙霧的主要氣體之一,丙是C的最高價氧化物對應的水化物,它們之間有如圖所示轉化關系。E是短周期中金屬性最強的元素,F與G位置相鄰,G是同周期元素中原子半徑最小的主族元素。請回答下列問題:

(1)C在元素周期表中的位置為_________。
(2)甲與丙的濃溶液反應的化學方程式_______________。
(3)D與E按原子個數比1:1形成化合物的電子式為________,其與水發生反應的化學方程式是_______________。
(4)E、F、G形成的簡單離子,半徑由大到小順序是________(用離子符號表示)。B、F、G元素的非金屬性由強到弱的順序__________(用元素符號表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某新型電池,以NaBH4(B的化合價為+3價)和H2O2作原料,負極材料采用Pt,正極材料采用MnO2(既作電極材料又對該極的電極反應具有催化作用),該電池可用作衛星、深水勘探等無空氣環境電源,其工作原理如圖所示。下列說法不正確的是

A. 每消耗3mol H2O2,轉移6mol e﹣
B. 電池工作時Na+從b極區移向a極區
C. a極上的電極反應式為:BH4﹣+8OH﹣﹣8e﹣═BO2﹣+6H2O
D. b極材料是MnO2,該電池總反應方程式:NaBH4 + 4H2O2===NaBO2 + 6H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲烷以天然氣和可燃冰兩種主要形式存在于地球上,儲量巨大,充分利用甲烷對人類的未來發展具有重要意義。
(1)乙炔(CH≡CH)是重要的化工原料。工業上可用甲烷裂解法制取乙炔,反應為:2CH4(g)![]() C2H2(g)+ 3H2(g)。甲烷裂解時還發生副反應: 2CH4(g)
C2H2(g)+ 3H2(g)。甲烷裂解時還發生副反應: 2CH4(g)![]() C2H4(g)+2H2(g)。甲烷裂解時,幾種氣體平衡時分壓(Pa)的對數即lgP與溫度(℃)之間的關系如圖所示。
C2H4(g)+2H2(g)。甲烷裂解時,幾種氣體平衡時分壓(Pa)的對數即lgP與溫度(℃)之間的關系如圖所示。

①1725℃時,向恒容密閉容器中充入CH4,達到平衡時CH4生成C2H2的平衡轉化率為_______。
②1725℃時,若圖中H2的lgP=5,則反應2CH4(g)![]() C2H2(g)+ 3H2(g)的平衡常數Kp=_________(注:用平衡分壓Pa代替平衡濃度mol/L進行計算)。
C2H2(g)+ 3H2(g)的平衡常數Kp=_________(注:用平衡分壓Pa代替平衡濃度mol/L進行計算)。
③根據圖判斷,2CH4(g)![]() C2H2(g)+3H2(g)△H_____0(填“>”或“<”)。由圖可知,甲烷裂解制乙炔過程中有副產物乙烯生成。為提高甲烷制乙炔的產率,除改變溫度外,還可采取的措施有_______。
C2H2(g)+3H2(g)△H_____0(填“>”或“<”)。由圖可知,甲烷裂解制乙炔過程中有副產物乙烯生成。為提高甲烷制乙炔的產率,除改變溫度外,還可采取的措施有_______。
(2)工業上用甲烷和水蒸氣在高溫和催化劑存在的條件下制得合成氣(CO、H2),發生反應為:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) △H>0
CO(g)+3H2(g) △H>0

圖中a、b、c、d四條曲線中的兩條代表壓強分別為1MPa、2MPa時甲烷含量曲線,其中表示1MPa的是________(填字母)。在實際生產中采用圖中M點而不是N點對應的反應條件,運用化學反應速率和平衡知識,同時考慮實際生產,說明選擇該反應條件的主要原因是__________。
(3)利用CH4、CO2在一定條件下重整的技術可得到富含CO的氣體,在能源和環境上具有雙重重大意義。重整過程中的催化轉化原理如圖所示:

已知: CH4(g)+ H2O(g) ![]() CO (g )+ 3H2(g) △H =+206.2 kJ/mol
CO (g )+ 3H2(g) △H =+206.2 kJ/mol
CH4(g)+ 2H2O(g) ![]() CO2(g )+4H2(g) △H =+158.6 kJ/mol
CO2(g )+4H2(g) △H =+158.6 kJ/mol
則:
①過程II中第二步反應的化學方程式為__________。
②只有過程I投料比![]() =______,過程II中催化劑組成才會保持不變。
=______,過程II中催化劑組成才會保持不變。
③該技術總反應的熱化學方程式為_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可逆反應:X(s)+Y(g)![]() 2Z(g)在容積為1L密閉容器反應,下列敘述不是反應達到平衡狀態的標志的是
2Z(g)在容積為1L密閉容器反應,下列敘述不是反應達到平衡狀態的標志的是
①單位時間內生成1molX的同時消耗2molZ ②Z的體積分數不再變化
③體系的壓強不再改變 ④Y、Z的物質的量濃度比為1:2
⑤Y的轉化率不再改變的狀態 ⑥混合氣體的密度不再改變的狀態
A. 僅①④ B. ①③④ C. ①④⑤ D. ②③⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】同溫同壓下,2H2(g)+O2(g)═2H2O(g)△H1;2H2(g)+O2(g)═2H2O(l)△H2 , 則△H1和△H2的關系是( )
A.△H1<△H2
B.△H1>△H2
C.△H1=△H2
D.無法判斷
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業焊接鋼管常用55137Cs進行“無損探傷”.下列有關說法正確的是( )
A.137表示質量數
B.137表示質子數
C.該原子質子數大于中子數
D.55表示中子數
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com