
【題目】A~H等八種物質存在如下轉化關系(反應條件、部分產物未標出).已知:A為正鹽,B是能使品紅溶液褪色的氣體,E是堿性氣體,G是紅棕色氣體.按要求回答問題: 
(1)寫出下列物質的化學式:
B , D , E , F .
(2)設計實驗檢驗A溶液中的陽離子,寫出實驗操作、現象和結論. .
【答案】
(1)SO2;H2SO4;NH3;NO
(2)取少量溶液于試管中,向其中加入加入濃NaOH溶液并加熱,若產生能使濕潤的紅色石蕊試紙變藍的氣體,則證明有NH4+ , 否則沒有
【解析】解:(1)G是紅棕色氣體,則G是NO2 , F和氧氣反應生成二氧化氮,所以F是NO;A是正鹽,和氫氧化鈉反應生成E,E和氧氣反應生成NO,則E是NH3 , A是銨鹽;二氧化氮和水反應后能生成H,是和水反應生成硝酸和NO,所以H是硝酸;B能使品紅溶液褪色,且B能和氧氣反應生成C,所以B是SO2 , C是SO3 , 三氧化硫和水反應生成D為H2SO4 , A是正鹽且是銨鹽,反應后能生成二氧化硫,所以A是(NH4)2SO3 .
所以答案是:SO2;H2SO4;NH3;NO;(2)A中陽離子為NH4+ , 檢驗NH4+離子方法是:取少量該溶液于試管中,加入氫氧化鈉溶液,加熱,如果生成的氣體能使濕潤的紅色石蕊試紙變藍色,則證明有NH4+ , 所以答案是:取少量溶液于試管中,向其中加入加入濃NaOH溶液并加熱,若產生能使濕潤的紅色石蕊試紙變藍的氣體,則證明有NH4+ , 否則沒有.


 華東師大版一課一練系列答案
華東師大版一課一練系列答案科目:高中化學 來源: 題型:
【題目】下面關于化學反應的限度的敘述中,正確的是
A. 化學反應的限度都相同
B. 可以通過改變溫度控制化學反應的限度
C. 可以通過延長化學反應的時間改變化學反應的限度
D. 當一個化學反應在一定條件下達到限度時,反應即停止
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】兩種氣態烴的混合物共1L,在空氣中完全燃燒得到1.5L CO2和2L水蒸氣(體積均在同溫同壓下測定),關于此混合烴的判斷正確的是( )
A.肯定是甲烷和乙烯的混合物
B.一定不是甲烷和乙烯的混合物
C.一定含乙烯,不含甲烷
D.兩種烴分子中氫原子數都是4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液中含H+、SO42﹣、NO3﹣三種離子,其中H+、SO42﹣的物質的量濃度分別為7.0molL﹣1和2.0molL﹣1 . 取該溶液20mL,加入3.2g銅粉,加熱使它們充分反應,產生的氣體在標準狀況下的體積約為( )
A.0.75 L
B.0.336 L
C.1.5 L
D.0.448 L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“一碳化學”是指以含一個碳原子的化合物(如:CO2、CO、CH4、CH3OH等)為初始反應物,合成一系列重要的化工原料和燃料的化學。
(1)以CO2和NH3為原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反應可表示如下:
反應I:2NH3(g)+CO2(g)=NH2COONH4(s)△H1
反應II:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol
總反應:2NH3(g)+CO2(g)==CO(NH2)2(s)+H2O(g) △H3=-86.98kJ/mol
請回答下列問題:
①反應I的△H1=______ kJ/mol
②反應II一般在_________(填“高溫”或“低溫”)情況下有利于該反應的進行。
③一定溫度下,在體積為固定的密閉容器中按計量比進行反應I,下列能說明反應達到了平衡狀態的是__________(填序號)。
A.混合氣體的平均相對分子質量不再變化 B.容器內氣體總壓強不再變化
C.2V正(NH3)=V逆(CO2) D.容器內混合氣體的密度不再變化
④環境為真空時,在一敞開容器(非密閉容器)中加入NH2COONH4固體,足夠長時間后,反應是否建立平衡狀態? ___________(填“是”或“否”)
(2)將CO2和H2充入一定體積的密閉容器中,在兩種溫度下發生反應:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。測得CH3OH的物質的量隨時間的變化如下圖。
CH3OH(g)+H2O(g)。測得CH3OH的物質的量隨時間的變化如下圖。
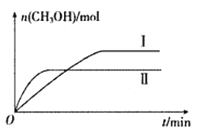
①曲線I.II對應的平衡常數大小關系為KI_______KII(填“ >”、“<”或“=”)。
②一定溫度下,在容積相同且固定的兩個密閉容器中,按如下方式加入反應物,一段時間后達到平衡。
容器 | 甲 | 乙 |
反應物投入量 | 1molCO2、3molH2 | amolCO2、bmolH2 cmol CH3OH(g)、cmolH2O(g)(a、b、c均不為零) |
若甲容器平衡后氣體的壓強為開始的0.8倍,則甲容器平衡混合氣體中CH3OH(g)的體積分數為_______,要使平衡后乙容器與甲容器中相同組分的體積分數相等,且起始時維持化學反應向逆反應方向進行,乙容器中c的取值范圍為________。
(3)以TiO2/Cu2Al2O4為催化劑,可以將CO2和CH4直接轉化成乙酸。在不同溫度下催化劑的催化效率與乙酸的生成速率的關系如下圖,乙酸的生成速率主要取決于溫度影響的范圍是________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是元素周期表的一部分
A | |||||||||||||||||
B | C | D | E | F | |||||||||||||
H | I | J | K | ||||||||||||||
L | M | O |
(1)元素L的價電子排布圖為__________,元素M的原子結構示意圖為________,位于元素周期表五個區域中的_______區。上述元素中電負性最強的是_______(用元素符號表示),C、D、E、F第一電離能的大小順序為____________(用元素符號表示)。
(2)D的氫化物和J氫化物沸點較高的是______(填化學式),穩定性更強的是______(填化學式)。
(3)某些不同族元素的性質也有一定的相似性,如上表中元素I與元素B的單質有相似的性質。寫出元素單質B與NaOH溶液反應的離子方程式___________________________。
(4)A、E、H、J四種元素的原子半徑由大到小的排列順序為___________________;E、F、H、K四種元素簡單離子的半徑由大到小的排列順序為________________用元素符號表示)。
(5)能證明元素K比元素J的非金屬性強的事實是______________(填序號)。
A.常溫下K單質的密度小于J單質的密度
B.K元素的氣態氫化物比J元素的氣態氫化物更穩定
C.K單質與氫氣反應的程度比J單質與氫氣反應的程度更劇烈
D.K元素的氧化物對應的水化物酸性強于J元素的氧化物對應的水化物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列溶液中NO3-的物質的量濃度最大的是
A.500 mL 1 mol/L的KNO3溶液B.500 mL1 mol/L的Ba(NO3)2溶液
C.1000 mL 0.5 mol/L的Mg(NO3)2溶液D.1 L 0.5 mol/L的Fe(NO3)3溶液
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com