
【題目】二茂鐵[Fe(C5H5)2]可用作火箭燃料添加劑、汽油的抗爆劑和橡膠的熟化劑,也可作紫外線吸收劑。可由環戊二烯(![]() )和FeCl2在三乙胺[(C2H5)3N]存在下反應制得。
)和FeCl2在三乙胺[(C2H5)3N]存在下反應制得。
(1)在元素周期表中,與Fe既同周期又同族且價層電子總數為10的元素是_____(填元素符號),該元索基態原子核外N層電子的自旋狀態_______(填“相同”或“相反”)。
(2)三乙胺中電負性最小的元素是________(填元素符號);C元素的_______雜化軌道與H元素的________軌道形成_______鍵。
(3)下列狀態的Cl中,電離最外層一個電子所需能量最大的是______(填序號)。
A. [Ne]![]() B. [Ne]
B. [Ne] ![]()
C. [Ne] ![]() D. [Ne]
D. [Ne] ![]()
(4)已知:分子中的大π鍵可用符號![]() 表示,其中m代表參與形成大π鍵的原子數,n代表參與形成的大π鍵的電子數(如苯分子中的大π鍵可表示為
表示,其中m代表參與形成大π鍵的原子數,n代表參與形成的大π鍵的電子數(如苯分子中的大π鍵可表示為![]() ),則環戊二烯負離子(
),則環戊二烯負離子(![]() )中的大π鍵應表示為________。
)中的大π鍵應表示為________。
(5)二茂鐵易升華且可溶于有機溶劑中,其晶體類型為________,二茂鐵的晶胞結構如圖所示(未畫出微粒),密度為pg·cm-3,則一個晶胞中Fe(C5H5)2。數目的計算表達式為______(設阿伏加德羅常數的值為NA)。

【答案】Ni 相反 H sp3 1s ![]() D
D ![]() 分子晶體
分子晶體 ![]()
【解析】
(1) Fe為第四周期第VIII族的元素,在元素周期表中,與Fe既同周期又同族的元素為鈷鎳兩種元素,符合價層電子排布總數為10的元素是Ni,價層電子排布為3d84s2,,該元素基態原子核外電子排布為N層電子的自旋狀態相反,故答案:Ni;相反;
(2) 三乙胺的化學式為(C2H5)3N,非金屬性越小,電負性越小,所以三乙胺中電負性最小的元素是H;依據價層電子理論,三乙胺 (C2H5)3N中C元素的價層電子數為4,所以為sp3雜化,雜化軌道與H元素的1s軌道形成![]() 鍵,故答案:H;sp3;1s;
鍵,故答案:H;sp3;1s;![]() ;
;
(3)根據核外電子軌道排布圖結合洪特規則可知:[Ne] ![]() 的結構最穩定,所以電離最外層一個電子所需能量最大,故答案D;
的結構最穩定,所以電離最外層一個電子所需能量最大,故答案D;
(4)環戊二烯負離子(![]() )的化學式為C5H6-,分子中的大π鍵是由每個H原子提供一個電子,每個C原子提供1個電子形成的,所以環戊二烯負離子(
)的化學式為C5H6-,分子中的大π鍵是由每個H原子提供一個電子,每個C原子提供1個電子形成的,所以環戊二烯負離子(![]() )中的大π鍵應表示為
)中的大π鍵應表示為![]() ,故答案:
,故答案:![]() ;
;
(5)根據二茂鐵[Fe(C5H5)2]易升華且可溶于有機溶劑的性質,可以推測二茂鐵晶體類型為分子晶體;設一個晶胞中Fe(C5H5)2數目為n,根據二茂鐵的晶胞結構圖所示,根據密度公式![]() =
=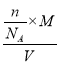 =
= =p,解得n=
=p,解得n=![]() ,故答案:分子晶體;n=
,故答案:分子晶體;n=![]() 。
。


科目:高中化學 來源: 題型:
【題目】對于可逆反應N2(g)+3H2(g) ![]() 2NH3(g) △H<0,下列研究目的和示意圖相符的是( )
2NH3(g) △H<0,下列研究目的和示意圖相符的是( )
A | B | C | D | |
研究目的 | 壓強對反應的影響 (p2>p1) | 溫度對反應的影響 | 平衡體系中增加N2的濃度對反應的影響 | 催化劑對反應的影響 |
示意圖 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙醇分子中各化學鍵如圖所示,下列關于乙醇在不同的反應中斷裂化學鍵的說法錯誤的是( )
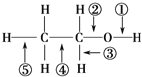
A.與金屬鈉反應時,鍵①斷裂
B.在Cu催化下與![]() 反應時,鍵①、③斷裂
反應時,鍵①、③斷裂
C.與乙酸、濃硫酸共熱發生酯化反應時,鍵①斷裂
D.與乙酸、濃硫酸共熱發生酯化反應時,鍵②斷裂
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】H、C、N、O、V(釩)五種元素形成的某分子結構如圖所示,下列說法錯誤是
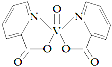
A.N原子核外存在3種不同能量的電子
B.基態V原子的價電子軌道表示式為![]()
C.基態O原子,電子占據的最高能級符號為2p
D.基態C、N兩種原子中,核外存在相同對數自旋方向相反的電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Li是最輕的固體金屬,采用Li作為負極材料的電池具有小而輕、能量密度大等優良性能,得到廣泛應用。回答下列問題:
(1)下列Li原子電子排布圖表示的狀態中,能量最低和最高的分別為_____、_____(填標號)
A. B.
B.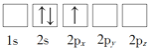
C.![]() D.
D.![]()
(2)LiAlH4是有機合成中常用的還原劑,LiAlH4中的陰離子空間構型是___________,中心原子的雜化形式為___________,LiAlH4中存在___________(填標號)
A.離子鍵 B.σ鍵 C.π鍵 D.氫鍵
(3)基態K原子中,核外電子占據最高能層的符號是___________,占據該能層電子的電子云輪廓圖形狀是____________;K和Cr屬于同一周期,且核外最外層電子構型相同,但金屬K的熔沸點等都比Cr低,原因是___________
(4)乙二胺(H2NCH2CH2NH2)是一種有機化合物,分子中氮、碳的雜化類型分別是_____________、_____________
(5)氣態三氧化硫以單分子形式存在,其分子的立體構型為_________,其中共價鍵的類型有____
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素A、B、C、D、E、F六種元素,它們的原子序數由A到F依次增大。在周期表中,A的原子半徑最小。B元素的原子最外層電子數是內層電子數的兩倍,C為地殼中含量最多的元素,D是原子半徑最大的短周期主族元素,D單質燃燒時呈現黃色火焰,D的單質在高溫下與C的單質充分反應,可以得到與E單質顏色相同的淡黃色固態化合物。D與F形成的離子化合物DF是常用的調味品。試根據以上敘述回答:
(1)元素名稱:
A________、B________、C________、D________。
(2)E在元素周期表中的位置:_________________________________________________。
(3)F離子結構示意圖:_____________________________________________________。
(4)A、B組成的最簡單化合物的名稱是____________________________________________。
(5)C、D按原子個數比1∶1組成的一種化合物與水發生反應的化學方程式為___________________________________________________________。
(6)能說明E的非金屬性比F的非金屬性____(填“強”或“弱”)的事實是________(舉一例)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Mn、Fe均為第4周期過渡金屬元素,兩元素的部分電離能數據如下表:
元素 | Mn | Fe | |
電離能/(kJ·mol-1) | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
回答下列問題:
(1)Mn元素基態原子價電子層的電子排布式為__;比較兩元素的I2、I3可知,氣態Mn2+再失去一個電子比氣態Fe2+再失去一個電子難,其原因是__。
(2)金屬鐵的晶體在不同溫度下有兩種堆積方式,晶胞分別如圖所示。面心立方晶胞和體心立方晶胞中實際含有的Fe原子個數之比為__,Fe原子配位數之比為__。
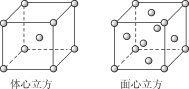
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是( )
A.標準狀況下,22.4 L水中所含的分子數約為6.02×1023個
B.1 mol Cl2中含有的原子數為NA
C.標準狀況下,aL氧氣和氮氣的混合物含有的分子數約為![]() ×6.02×1023個
×6.02×1023個
D.常溫常壓下,11.2 L CO分子數是0.5NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨在工農業生產中應用廣泛。在壓強為30MPa時,不同溫度時合成氨平衡混合氣體中NH3的體積分數如下:
溫度/℃ | 200 | 300 | 400 | 500 | 600 |
氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
請回答:
(1)根據圖中所示,合成氨的熱化學方程式為___。
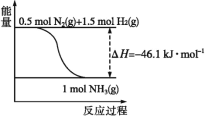
(2)將1molN2(g)和3molH2(g)通入一密閉容器中,在催化劑存在時進行反應,測得反應放出的熱量___92.2kJ(填“大于”“等于”或“小于”),原因是___;若加入催化劑,ΔH___(填“變大”“變小”或“不變”)。
(3)已知破壞1molN≡N鍵、1molH—H鍵需要吸收的能量分別為946kJ、436kJ,則破壞1molN—H鍵需要吸收的能量為___kJ。
(4)N2H4可視為NH3分子中的一個H被—NH2取代的產物。發射衛星用N2H4(g)為燃料,以NO2為氧化劑發生反應生成N2和H2O(g)。
已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ·mol-1。
則1molN2H4與NO2完全反應的熱化學方程式為___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com