
【題目】(1)氮氧化物是形成光化學煙霧和酸雨的一個重要原因,用CH4催化還原NOx可在一定程度上消除氮氧化物的污染。
已知:![]() △H=-1160kJ·mol-1
△H=-1160kJ·mol-1
![]() △H=+293kJ·mol-1
△H=+293kJ·mol-1
則該條件下,CH4催化還原NO2消除污染的熱化學方程式為________________________。
(2)乙炔(CH≡CH)是重要的化工原料。工業上可用甲烷裂解法制取乙炔:![]() 同時發生副反應:
同時發生副反應:![]() ;甲烷裂解時,幾種氣體平衡時分壓(Pa)的對數即lgP與溫度(℃)之間的關系如圖所示。根據圖判斷,反應
;甲烷裂解時,幾種氣體平衡時分壓(Pa)的對數即lgP與溫度(℃)之間的關系如圖所示。根據圖判斷,反應![]() △H___0(填“>”或“<”)。
△H___0(填“>”或“<”)。

1725℃時,向恒容密閉容器中充入CH4,達到平衡時CH4生成C2H2的平衡轉化率為_____。該溫度下,![]() 的平衡常數Kp=_______[注:用平衡分壓(Pa)代替平衡濃度(mol·L-1)進行計算]。
的平衡常數Kp=_______[注:用平衡分壓(Pa)代替平衡濃度(mol·L-1)進行計算]。

(3)利用在特定條件下用鉑電極(陽極為鉑絲)電解飽和硫酸氫鉀溶液的方法制備K2S2O8(過二硫酸鉀)。在低溫下電解液中主要含有K+、H+和![]() 離子,電流通過溶液后發生反應。陽極區電極反應式為______________________________,X為_________交換膜(填“質子”、“陽離子”或“陰離子”),當電路中通過0.2mol e-時,兩邊溶液質量的變化差為_________。
離子,電流通過溶液后發生反應。陽極區電極反應式為______________________________,X為_________交換膜(填“質子”、“陽離子”或“陰離子”),當電路中通過0.2mol e-時,兩邊溶液質量的變化差為_________。
(4)甲烷燃料電池采用鉑為電極,兩電極上分別通入CH4和O2,電解質溶液為300mL 1.0mol·L-1的NaOH溶液。當O2通入量為8.96L(標準狀況)且反應完全時,所得溶液中各離子濃度由大到小的順序為_______________________________。
【答案】CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H=-867kJmol-1 > 62.5% 102.4Pa 2HSO4-—2e-=S2O82-+2H+ 質子 0.2g c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
N2(g)+CO2(g)+2H2O(g) △H=-867kJmol-1 > 62.5% 102.4Pa 2HSO4-—2e-=S2O82-+2H+ 質子 0.2g c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
【解析】
根據蓋斯定律分析熱化學方程式的書寫和反應熱,根據平衡的影響因素和平衡的三段式計算平衡常數。根據電解原理分析陽極和陰極的電極反應,根據溶液中的離子的變化分析兩極溶液的質量變化。
(1)①![]() △H=-1160kJ·mol-1,②
△H=-1160kJ·mol-1,②![]() △H=+293kJ·mol-1,根據蓋斯定律分析,①+②得熱化學方程式為:CH4(g)+2NO2(g)
△H=+293kJ·mol-1,根據蓋斯定律分析,①+②得熱化學方程式為:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H=-1160+293=-867kJmol-1
N2(g)+CO2(g)+2H2O(g) △H=-1160+293=-867kJmol-1
(2)從圖分析,隨著溫度升高,甲烷的分壓(Pa)的對數變大,說明甲烷減少,則說明升溫平衡正向移動,即△H >0; 從圖分析,達到平衡時乙炔的分壓為100 Pa,則消耗的甲烷的分壓為200Pa,乙烯的分壓為10 Pa,消耗的甲烷的分壓為20Pa,剩余甲烷的分壓為100 Pa,最初甲烷的分壓為100+200+20=320 Pa,則甲烷生成乙炔的平衡轉化率為200/320=62.5%。平衡時甲烷的分壓為100 Pa,乙烯的分壓為10 Pa,則氫氣的分壓為300+20=320 Pa,平衡常數為![]() =102.4Pa。
=102.4Pa。
(3)電解硫酸氫鉀溶液制備過二硫酸鉀,所以說明硫元素化合價升高,即陽極為硫酸氫離子失去電子生成過二硫酸根離子,電極反應為:2HSO4-—2e-=S2O82-+2H+;溶液為酸性,反應生成過多的氫離子,陰極反應為:2H++2e-=H2,所以為質子交換膜。當有0.2mol電子轉移時,陽極區向陰極區轉移0.2mol氫離子,陰極區有0.2mol氫離子變成氫氣,陰極區質量不變,所以兩邊質量變化差為0.2g。
(4)當O2通入量為8.96L時,即0.4mol氧氣,則消耗0.2mol甲烷,生成0.2mol二氧化碳,與0.3mol氫氧化鈉反應,生成0.1mol碳酸鈉和0.1mol碳酸氫鈉,因為碳酸根離子水解程度比碳酸氫根大,所以溶液中碳酸氫根離子濃度大于碳酸根離子濃度,溶液顯堿性,故離子濃度順序為:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。


 優學名師名題系列答案
優學名師名題系列答案科目:高中化學 來源: 題型:
【題目】下面列出了幾組物質,請將物質的合適組號填寫在空格上。同位素 ,同系物 ,同素異形體 ,同分異構體 。
①金剛石與“足球烯”C60; ②D與T; ③16O、17O和18O;④氧氣(O2)與臭氧(O3); ⑤CH4和CH3CH2CH3;⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);
⑦![]() ⑧
⑧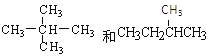
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由A、B、C、D四種金屬按下表中裝置進行實驗。
裝置 |
|
|
|
現象 | 二價金屬A不斷溶解 | C的質量增加 | A上有氣體產生 |
根據實驗現象回答下列問題:
(1)裝置甲中負極的電極反應式是______________________________________。
(2)裝置乙中正極的電極反應式是_______________________________________。
(3)裝置丙中溶液的pH________(填“變大”、“變小”或“不變”)。
(4)四種金屬活動性由強到弱的順序是___________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為研究廢舊電池的再利用,實驗室利用舊電池的銅帽(主要成分為Zn和Cu)回收Cu并制備ZnO的部分實驗過程如圖所示。下列敘述錯誤的是

A. “溶解”操作中溶液溫度不宜過高
B. 銅帽溶解后,將溶液加熱至沸騰以除去溶液中過量的氧氣或H2O2
C. 與鋅粉反應的離子可能為Cu2+、H+
D. “過濾”操作后,將濾液蒸發結晶、過濾、洗滌、干燥后,高溫灼燒即可得純凈的ZnO
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究CO2的綜合利用對促進“低碳經濟”的發展有重要意義。
(1)工業上以CO2、NH3為原料生產尿素[CO(NH2)2],反應實際為兩步進行:
I:2NH3(g)+CO2(g)![]() H2NCOONH4(s) △H1=-272kJ·mol-1
H2NCOONH4(s) △H1=-272kJ·mol-1
II:H2NCOONH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+138kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2=+138kJ·mol-1
已知:H2O(l)==H2O(g) △H3=+44kJ·mol-1
①請寫出以NH3、CO2為原料,合成尿素和液態水的熱化學方程式______________。
②T1℃時,在1L的密閉容器中充入CO2和NH3模擬工業生產,n(NH3)/n(CO2)=x,如圖是CO2平衡轉化率(![]() )與x的關系。求圖中A點NH3的平衡轉化率
)與x的關系。求圖中A點NH3的平衡轉化率![]() =________%。
=________%。
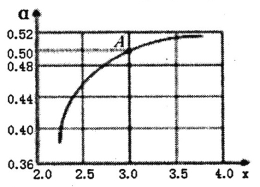
③當x=1.0時,若起始的壓強為p0kPa,水為液態,平衡時壓強變為起始的1/2。則該反應的平衡常數Kp=_______(kPa)-3(KP為以分壓表示的平衡常數)。
(2)用CO2和H2合成甲醇:3H2(g)+CO2(g)![]() CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。在T℃時,甲、乙、丙三個2L的恒容密閉容器中,按不同方式投入反應物,測得平衡時有關數據如下:
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。在T℃時,甲、乙、丙三個2L的恒容密閉容器中,按不同方式投入反應物,測得平衡時有關數據如下:
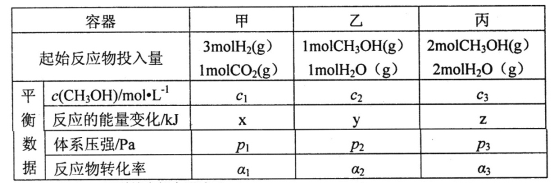
①甲容器10s達到平衡時測得x=39.2,則甲中CO2的平均反應速率____________。
②下列說法正確的是________(填字母編號)。
A.2c1<c3 B.z<2y C.p3>2p2 D.α1+α3>1
(3)用NaOH溶液做碳捕捉劑可獲得化工產品Na2CO3。常溫下若某次捕捉后得到pH=10的溶液,則溶液中c(CO32-):c(HCO3-)=_____[K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11],溶液中c(Na+)_____c(HCO3-)+2c(CO32-)(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對滴有酚酞試液的下列溶液,操作后顏色變深的是
A. 明礬溶液加熱 B. CH3COONa溶液加熱
C. 氨水中加入少量NH4Cl固體 D. 小蘇打溶液中加入少量NaCl固體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯化鉀樣品中含有少量碳酸鉀、硫酸鉀和不溶于水的雜質。為了提純氯化鉀,先將樣品溶于適量水中,充分攪拌后過濾,再將濾液按下圖所示步驟進行操作。提示:圖中A代表沉淀或者溶液

(1)檢驗提純后的KCl中是否還含有SO42-的方法是____________________________。
(2)用提純后的KCl配制980 mL 1.00 mol/L的氯化鉀溶液,回答下列問題:
①根據計算,所需稱量的KCl的質量為__________。
②容量瓶上標有:①溫度、②濃度、③容量、④壓強、⑤刻度線這五項中的______。(填數字符號)
③下列操作會使所配溶液濃度偏低的是__________(填選項代號)。
A.配制前容量瓶內壁刻度線以下存有水珠 B.沒有洗滌燒杯內壁
C.轉移溶液時部分溶液濺出容量瓶外 D.定容時俯視
(3)試劑Ⅰ的名稱為______,試劑Ⅱ的化學式為______,試劑Ⅲ的化學式為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:A是來自石油的重要的基本有機化工原料,A的產量可以用來衡量一個國家的石油化工水平,E是具有果香味的有機物,F是一種高聚物,可制成多種包裝材料。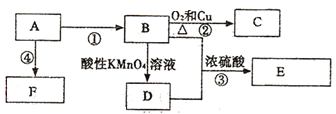
(1)A的電子式為____,C的名稱_____,F的結構簡式_____。
(2)D分子中的官能團名稱是_____,請設計一種實驗來驗證D物質存在該官能團的方法是_____。
(3)寫出下列反應的化學方程式并指出反應類型:③_______,反應類型_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向某4L密閉容器中加入一定量的A、B、C三種氣體,一定條件下發生反應,各物質濃度隨時間變化如甲圖所示。乙圖為達到平衡后在t2、t3、t4、t5時改變某一種反應條件,平衡體系中速率隨時間變化的情況,且所改變的條件均不同。已知t3-t4階段為使用催化劑。則下列說法不正確的是
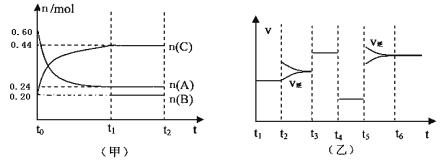
A.若t1=15s,則t0—t1階段以A濃度變化表示的反應速率v(A)為0.006mol/(L·s)
B.B既不是反應物,也不是生成物,可能是反應的催化劑
C.若t2—t3階段改變的條件是增大A的濃度,則平衡時C的體積分數變小。
D.該反應為放熱反應,t5—t6階段是升高反應體系的溫度
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com