科學家一直致力于研究常溫、常壓下“人工固氮”的新方法.曾有實驗報道:在常溫、常壓、光照條件下,N
2在催化劑(摻有少量Fe
2O
3的TiO
2)表面與水發生反應,生成的主要產物為NH
3.進一步研究NH
3生成量與溫度的關系,部分實驗數據見下表(光照、N
2壓力1.0×10
5 Pa、反應時間3h):
| T/K |
303 |
313 |
323 |
353 |
| NH3生成量/(10-6 mol) |
4.8 |
5.9 |
6.0 |
2.0 |
相應的化學方程式:N
2(g)+3H
2O(l)?2NH
3(g)+
O
2(g)△H=+765.2kJ?mol
-1回答下列問題:
(1)該反應在較低溫度下能否自發進行?
;
(2)從323K到353K,氨氣的生成量減少的原因
;
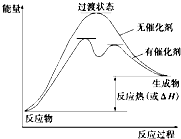
(3)請畫出上述反應在有催化劑與無催化劑兩種情況下反應過程中體系能量變化示意圖1,并進行必要標注;
(4)工業合成氨的反應為N
2(g)+3H
2(g)?2NH
3(g).設在容積為2.0L的密閉容器中充入0.60mol N
2(g)和1.60mol H
2(g),反應在一定條件下達到平衡時,NH
3的物質的量分數(NH
3的物質的量與反應體系中總的物質的量之比)為
.該條件下反應2NH
3(g)?N
2(g)+3H
2(g)的平衡常數為
;
(5)利用N
2和H
2可以實驗NH
3的工業合成,而氨又可以進一步制備硝酸,在工業上一般可進行連續生產.請回答下列問題:
已知:N
2(g)+O
2(g)═2NO(g)△H=+180.5kJ?mol
-1N
2(g)+3H
2(g)═2NH
3(g)△H=-92.4kJ?mol
-12H
2(g)+O
2(g)═2H
2O(g)△H=-483.6kJ?mol
-1則氨氣經催化氧化生成一氧化氮氣體和水蒸氣的熱化學方程式為
;
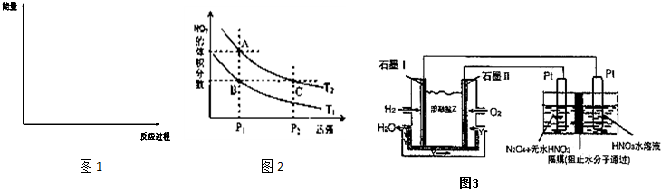
(6)對反應N
2O
4(g)?2NO
2(g),在溫度分別為T
1、T
2時,平衡體系中NO
2的體積分數隨壓強變化曲線如圖2所示.下列說法正確的是
;
A.A、C兩點的反應速率:A>C
B.B、C兩點的氣體的平均相對分子質量:B<C
C.A、C兩點氣體的顏色:A深,C淺
D.由狀態B到狀態A,可以用加熱的方法
(7)現以H
2、O
2、熔融鹽Na
2CO
3組成的燃料電池,采用電解法制備N
2O
5,裝置如圖3所示,其中Y為CO
2.寫出石墨I電極上發生反應的電極反應式
;在電解池中生成1molN
2O
5轉移電子的物質的量為
.


 ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案

 2NH3(g).設在容積為2.0L的密閉容器中充入0.60mol N2(g)和1.60molH2(g),反應在一定條件下達到平衡時,NH3的物質的量分數(NH3的物質的量與反應體系中總的物質的量之比)為
2NH3(g).設在容積為2.0L的密閉容器中充入0.60mol N2(g)和1.60molH2(g),反應在一定條件下達到平衡時,NH3的物質的量分數(NH3的物質的量與反應體系中總的物質的量之比)為 N2(g)+3H2(g)的平衡常數.
N2(g)+3H2(g)的平衡常數. 自然界里氮的固定途徑之一是在閃電的作用下,N2與O2反應生成NO.
自然界里氮的固定途徑之一是在閃電的作用下,N2與O2反應生成NO. 2NO(g) DH=a kJ·mol-1的平衡常數K如下表:
2NO(g) DH=a kJ·mol-1的平衡常數K如下表: 2NO(g)達到平衡時N2的濃度為 。(此溫度下不考慮O2與NO的反應。計算結果保留兩位有效數字)
2NO(g)達到平衡時N2的濃度為 。(此溫度下不考慮O2與NO的反應。計算結果保留兩位有效數字)