
【題目】已知某有機物A的紅外光譜和核磁共振氫譜如圖所示,下列說法中錯誤的是( )
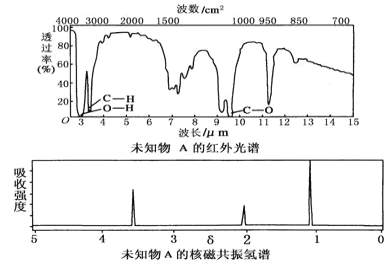
A.由紅外光譜可知,該有機物中至少有三種不同的化學鍵
B.由核磁共振氫譜可知,該有機物分子中有三種不同化學環境的氫原子
C.僅由其核磁共振氫譜無法得知其分子中的氫原子總數
D.若A的化學式為C2H6O,則其結構簡式為CH3—O—CH3
科目:高中化學 來源: 題型:
【題目】Fe、Co、Ni是三種重要的金屬元素。回答下列問題:
(1)Fe、Co、Ni在周期表中的位置為_________,基態Fe原子的電子排布式為__________。
(2)CoO的面心立方晶胞如圖所示。設阿伏加德羅常數的值為NA,則CoO晶體的密度為______g﹒cm-3:三種元素二價氧化物的晶胞類型相同,其熔點由高到低的順序為_______。

(3)Fe、Co、Ni能與C12反應,其中Co和為Ni均生產二氯化物,由此推斷FeCl3、CoCl3和Cl2的氧化性由強到弱的順序為____,Co(OH)3與鹽酸反應有黃綠色氣體生成,寫出反應的離子方程式:______。
(4)95℃時,將Ni片浸在不同質量分數的硫酸中,經4小時腐蝕后的質量損失情況如圖所示,當![]() 大于63%時,Ni被腐蝕的速率逐漸降低的可能原因為_____。由于Ni與H2SO4反應很慢,而與稀硝酸反應很快,工業上選用H2SO4和HNO3的混酸與Ni反應制備NiSO4。為了提高產物的純度,在硫酸中添加HNO3的方式為______(填“一次過量”或“少量多次”),此法制備NiSO4的化學方程式為_______。
大于63%時,Ni被腐蝕的速率逐漸降低的可能原因為_____。由于Ni與H2SO4反應很慢,而與稀硝酸反應很快,工業上選用H2SO4和HNO3的混酸與Ni反應制備NiSO4。為了提高產物的純度,在硫酸中添加HNO3的方式為______(填“一次過量”或“少量多次”),此法制備NiSO4的化學方程式為_______。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氟磷灰石是常見的鈣氟磷酸鹽礦物,其化學式為Ca5(PO4)3F,由氟磷灰石制取黃磷(P4)的化學式為4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g),請回答下列問題:
(1)基態Ca原子電子所占據最高能級的電子云輪廓圖為________,基態P原子的價電子軌道表達式為________。
(2)由氟磷灰石制取黃磷(P4)產物中屬于極性分子的化合物是________,與其互為等電子體的分子為________。
(3)黃磷(P4)晶體的空間結構如圖甲所示,P的雜化軌道類型為________,磷的一種硫化物P4S3的空間結構如圖乙所示,每個S原子中含有孤電子對的數目為________。


(4)SiO2的沸點________(填“大于”或“小于”)CO2的沸點,其原因為________。
(5)Ca與Ti、O元素形成的化合物的晶胞結構如圖所示,則該晶體的化學式為________,若晶胞密度為ρgcm-3,阿伏加德羅常數的值為NA,則該晶胞中兩個距離最近的O原子之間的距離為________pm(用含ρ、NA的表達式表示)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】無色的混合氣體甲中可能含有NO、CO2、NO2、NH3、N2中的幾種,將100mL氣體甲經過如圖所示實驗處理,結果得到酸性溶液,而幾乎無氣體剩余,則氣體甲的組成可能為( )
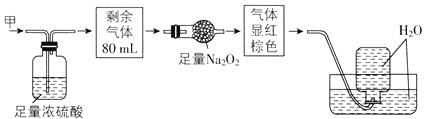
A.NO2、NH3、N2B.NH3、NO、CO2
C.NH3、NO2、CO2D.NO、CO2、N2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上可利用![]() 和
和![]() 制備多種物質。請回答下列問題:
制備多種物質。請回答下列問題:
(1)反應Ⅰ:![]() H1平衡常數為K1
H1平衡常數為K1
反應Ⅱ:![]() H2平衡常數為K2
H2平衡常數為K2
不同溫度下,K1、K2的值如表所示:
| K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
現有反應Ⅲ:![]() H3平衡常數為K3,結合上表數據分析,K3=________(用K1、K2表示)。反應Ⅲ是________(填“放熱”或“吸熱”)反應,為提高
H3平衡常數為K3,結合上表數據分析,K3=________(用K1、K2表示)。反應Ⅲ是________(填“放熱”或“吸熱”)反應,為提高![]() 的轉化率可采取的措施有________(寫出任意兩條)。
的轉化率可采取的措施有________(寫出任意兩條)。
(2)一定條件下,在密閉容器中充入![]() 和
和![]() 進行如下反應:
進行如下反應:![]()
![]() 。采用催化劑甲和催化劑乙分別發生上述反應,測得反應進行相同時間時
。采用催化劑甲和催化劑乙分別發生上述反應,測得反應進行相同時間時![]() 的轉化率隨反應溫度的變化曲線如圖所示(忽略溫度對催化劑活性的影響):
的轉化率隨反應溫度的變化曲線如圖所示(忽略溫度對催化劑活性的影響):
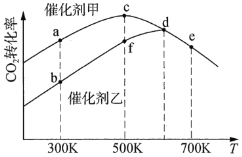
①該可逆反應的反應熱H________0(填“>”或“<”)。
②催化劑甲作用下反應的活化能比催化劑乙作用下反應的活化能________(填“大”或“小”)。
③![]() 下達到平衡時,反應在催化劑甲作用下的轉化率比在催化劑乙作用下的轉化率________(填“高”、“相等”或“低”)
下達到平衡時,反應在催化劑甲作用下的轉化率比在催化劑乙作用下的轉化率________(填“高”、“相等”或“低”)
④圖中達到平衡的點是________。
(3)工業上常用高濃度的![]() 溶液吸收
溶液吸收![]() ,得到溶液X,再利用電解法使
,得到溶液X,再利用電解法使![]() 溶液再生,其裝置示意圖如圖:
溶液再生,其裝置示意圖如圖:
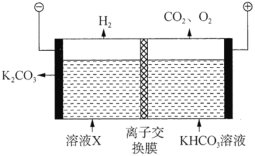
①在陽極區發生的反應有:________和![]() 。
。
②簡述![]() 在陰極區再生的原理:________。
在陰極區再生的原理:________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述中正確的是
A. 聚乙烯、植物油都是混合物,都能使溴的四氯化碳溶液褪色
B. 向氯乙烷中加入硝酸銀溶液,可以鑒定其中的氯原子
C. 將等體積的苯、汽油和水在試管中充分振蕩后靜置,現象如圖所示:
![]()
D. 可用灼燒的方法鑒別蛋白質和纖維素
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】欲使0.1mol·L-1的NaHCO3溶液中c(H+)、c(HCO3-)都減少而c(CO32-)增大,其方法是
A.通入二氧化碳氣體B.加入適量氫氧化鈉固體
C.通入氯化氫氣體D.加入飽和石灰水溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.(1)25℃時,10L水中含H+的個數為________個(設阿伏加德羅常數為NA,下同。),1g水中含H+的個數為________個。
(2)某溫度(t℃)時,水的Kw=1×10-12,則該溫度________25℃(填“>”“<”或“=”),該溫度下,c(H+)=1×10-7mol·L-1的溶液呈________(填“酸性”“堿性”或“中性”);若該溶液中只存在NaOH溶質,則由H2O電離出來的c(OH-)=________mol·L-1。
II.氯化鐵主要用于金屬蝕刻、污水處理,具有效果好、價格便宜等優點。請回答下列有關氯化鐵的問題:
(1)用FeCl3作凈水劑的原理用化學用語解釋為________,配制FeCl3溶液時需要加入少量的濃鹽酸,其作用為________。
(2)25℃時,Ksp[Fe(OH)3]=4.0×10-38。Fe3+發生水解反應Fe3++3H2O![]() Fe(OH)3+3H+,該反應的平衡常數為______________。
Fe(OH)3+3H+,該反應的平衡常數為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫,下列溶液中各濃度關系不正確的是
A. 等體積、等物質的量濃度的NaX和弱酸HX混合后的溶液pH>7,則一定有:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
B. 1L0.1molL-1CuSO4·(NH4)2SO46H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)
C. 0.1molL-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)≠c(HCO3-)+c(CO32-)+c(OH-)
D. 物質的量濃度分別為c1和c2的兩種醋酸溶液,若其pH分別為a和a+1,則c1>10c2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com