
【題目】氟磷灰石是常見的鈣氟磷酸鹽礦物,其化學式為Ca5(PO4)3F,由氟磷灰石制取黃磷(P4)的化學式為4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g),請回答下列問題:
(1)基態Ca原子電子所占據最高能級的電子云輪廓圖為________,基態P原子的價電子軌道表達式為________。
(2)由氟磷灰石制取黃磷(P4)產物中屬于極性分子的化合物是________,與其互為等電子體的分子為________。
(3)黃磷(P4)晶體的空間結構如圖甲所示,P的雜化軌道類型為________,磷的一種硫化物P4S3的空間結構如圖乙所示,每個S原子中含有孤電子對的數目為________。


(4)SiO2的沸點________(填“大于”或“小于”)CO2的沸點,其原因為________。
(5)Ca與Ti、O元素形成的化合物的晶胞結構如圖所示,則該晶體的化學式為________,若晶胞密度為ρgcm-3,阿伏加德羅常數的值為NA,則該晶胞中兩個距離最近的O原子之間的距離為________pm(用含ρ、NA的表達式表示)。

【答案】球形 ![]() CO N2 sp3雜化 2 大于 SiO2為原子晶體,CO2為分子晶體,原子晶體的熔沸點比分子晶體的熔沸點高 CaTiO3
CO N2 sp3雜化 2 大于 SiO2為原子晶體,CO2為分子晶體,原子晶體的熔沸點比分子晶體的熔沸點高 CaTiO3 ![]()
【解析】
(1)基態Ca原子的價電子排布式為4s2,電子所占據最高能級為4s;基態P原子的價電子排布式為3s23p3。
(2)由氟磷灰石制取黃磷(P4)產物中P4、SiF4為非極性分子,CaSiO3為離子化合物,CO為極性分子,若兩種離子或分子含有相同的原子數和價電子總數則互為等電子體。
(3)根據價層電子互斥理論進行判斷。
(4)原子晶體的熔沸點比分子晶體的熔沸點高。
(5)根據“均攤法”進行計算。
(1)基態Ca原子的價電子排布式為4s2,電子所占據最高能級為4s,其電子云輪廓圖為球形,基態P原子的價電子排布式為3s23p3,其價電子軌道表達式也就是價電子排布圖為![]() 。
。
(2)由氟磷灰石制取黃磷(P4)產物中P4、SiF4為非極性分子,CaSiO3為離子化合物,CO為極性分子,若兩種離子或分子含有相同的原子數和價電子總數則互為等電子體,故與CO互為等電子體的分子為N2。
(3)黃磷(P4)晶體的空間構型為正四面體,每個P原子含有的價層電子對數為3+(5-3)÷2=4,故P原子的雜化軌道類型為sp3雜化,P4S3中每個S原子與兩個P原子以單鍵相連,S原子的價層電子對數為2+(6-2)÷2=4,故S原子有兩對成鍵電子對和兩對孤電子對。
(4)SiO2的沸點大于CO2的沸點,其原因為SiO2為原子晶體,CO2為分子晶體,原子晶體的熔沸點比分子晶體的熔沸點高。
(5)根據“均攤法”可知,該晶胞中含有1個Ca2+、1個Ti4+和3個O2-,故其化學式為CaTiO3,設該晶胞參數為acm,則有![]() ,
,![]() ,兩個最近的O原子之間的距離為
,兩個最近的O原子之間的距離為![]() 單位換算可知結果為
單位換算可知結果為![]() 。
。


 一線名師提優試卷系列答案
一線名師提優試卷系列答案 陽光試卷單元測試卷系列答案
陽光試卷單元測試卷系列答案科目:高中化學 來源: 題型:
【題目】第ⅤA族元素的原子R與A原子結合形成RA3氣態分子,其立體結構呈三角錐形。RCl5在氣態和液態時,分子結構如圖所示,下列關于RCl5分子的說法中不正確的是( )
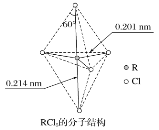
A.并不是每個原子都達到8電子穩定結構
B.鍵角(Cl—R—Cl)有90°、120°、180°幾種
C.RCl5受熱后會分解生成分子RCl3,RCl5和RCl3都是極性分子
D.分子中5個R—Cl鍵鍵能不都相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬晶體的原子堆積方式常有以下四種,請認真觀察模型(見圖),回答下列問題:
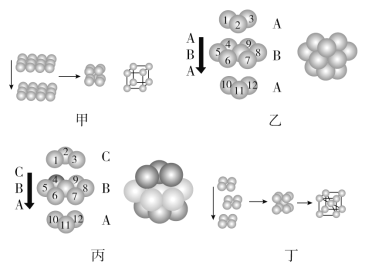
(1)四種堆積模型的堆積名稱依次是________、________、________、________。
(2)甲堆積方式中的空間利用率為________,只有金屬________采用這種堆積方式。
(3)乙與丙中兩種堆積方式中金屬原子的配位數________(填“相同”或“不相同”);乙中的空間利用率為________。
(4)采取丁中堆積方式的金屬通常有________(任寫三種金屬元素的符號),每個晶胞中所含有的原子數為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某硫酸工廠排放的尾氣中,含少量的二氧化硫。如果將一定體積的尾氣通入100mL2mol/L的氫氧化鈉溶液使其完全反應,經測定所得溶液含有16.7g溶質。試分析該溶液的成分,并計算確定各成分的物質的量___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1,4-環己二酮是一種重要的醫藥、液晶中間體。以工業原料乙烯為基礎的1,4-環已二酮(G)合成線路如圖所示:
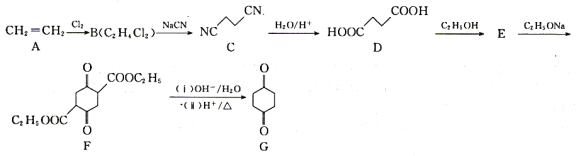
已知:2RCH2COOC2H5![]() +C2H5OH
+C2H5OH
(1)B和E的結構簡式分別為________、________。
(2)B→C的反應類型為________。
(3)碳原子上連有4個不同的原子或基團時,該碳稱為手性碳,用星號(*)標出F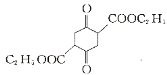 中的手性碳________。
中的手性碳________。
(4)由E→F的化學方程式為________。
(5)同時滿足下列條件的G的同分異構體的結構簡式________(不考慮立體異構)。
①能發生銀鏡反應;
②核磁共振氫譜顯示為2個峰,且峰面積之比為3:1。
(6)設計由乙烯(CH2=CH2)和乙醇(C2H5OH)制備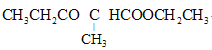 的合成路線________(無機試劑任選)
的合成路線________(無機試劑任選)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述不正確的是( )
A.向AlCl3溶液中滴加氨水,產生白色沉淀;再加入NaHSO4溶液,沉淀溶解
B.在Cu(NO3)2溶液中加入銅粉,銅粉不溶解;再加入稀硫酸溶液,銅粉溶解
C.用如圖所示的裝置可以測定黃銅(Cu,Zn合金)中Zn的含量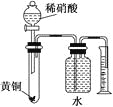
D.在FeCl3溶液中加入KSCN溶液,溶液變紅,加入足量鐵粉充分振蕩,溶液紅色褪去
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某有機物A的紅外光譜和核磁共振氫譜如圖所示,下列說法中錯誤的是( )
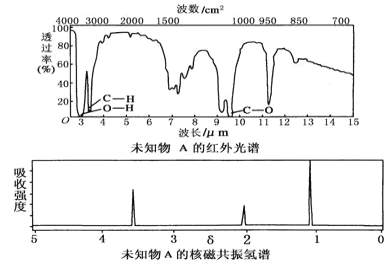
A.由紅外光譜可知,該有機物中至少有三種不同的化學鍵
B.由核磁共振氫譜可知,該有機物分子中有三種不同化學環境的氫原子
C.僅由其核磁共振氫譜無法得知其分子中的氫原子總數
D.若A的化學式為C2H6O,則其結構簡式為CH3—O—CH3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在無機化合物的提純中,常利用難溶電解質的溶解平衡原理除去某些雜質離子。現有含氯化亞鐵雜質的氯化銅晶體(CuCl2·2H2O),為制取純凈的CuCl2·2H2O,首先將其制成水溶液,然后按如圖步驟進行提純:
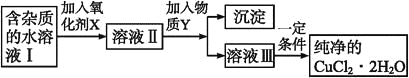
已知某溫度下:Cu2+、Fe3+和Fe2+的氫氧化物開始沉淀和沉淀完全時的pH,見下表:
Fe3+ | Fe2+ | Cu2+ | |
氫氧化物開始沉淀時的pH | 1.9 | 7.0 | 4.7 |
氫氧化物完全沉淀時的pH | 3.2 | 9.0 | 6.7 |
請回答下列問題:
(1)加入氧化劑X的目的是_______________________。
(2)最適合作氧化劑X的是___________(填編號,否則不給分);寫出氧化劑X參與的離子反應方程式_________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)為了除去Fe3+,需加入物質Y_________(填化學式)調節溶液的pH值為___________。
(4)最后能不能直接蒸發結晶得到CuCl2·2H2O晶體?________(填“能”或“不能”);若能,不用回答;若不能,回答該如何操作?____________________。
(5)常溫下已知Fe(OH)3的Ksp=1.0×10-35,向500mL 0.2mol/L的FeCl3溶液中加入NaOH固體(溶液體積變化忽略不計)后pH=3.0,則需要加入氫氧化鈉固體的質量為________g。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com