
【題目】下列各組元素,金屬性或非金屬性強弱比較正確的是
A. 金屬性:Na>K B. 非金屬性:O>S C. 金屬性:Mg<Al D. 非金屬性:F<Cl
科目:高中化學 來源: 題型:
【題目】同溫同壓下,質量相同的CO2、H2、O2、CH4、SO2五種氣體,下列說法錯誤的是:
A.所占的體積由大到小的順序是:H2>CH4>O2>CO2>SO2
B.所含分子數由多到少的順序是:H2>CH4>O2>CO2>SO2
C.密度由大到小的順序是:SO2>CO2>O2>CH4>H2
D.所含的電子數由多到少是:CO2>SO2>CH4>O2>H2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵紅(Fe2O3)常用作紅色油漆和涂料。下列有關Fe2O3的敘述正確的是
A. 能跟鹽酸反應 B. 可溶于水 C. 在空氣中易被氧化 D. 有磁性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于化學用語“NH4Cl”的意義,不正確的是( )
A.氯化銨分子中含有一個NH4+和一個C1-
B.氯化銨由N、H、C1三種元素組成
C.氯化銨晶體由NH4+和C1-構成
D.氯化銨晶體中陰、陽離子個數比為1: 1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下面是甲、乙、丙三位同學制取乙酸乙酯的過程,請你參與并協助他們完成相關實驗任務。
【實驗目的】制取乙酸乙酯
【裝置設計】甲、乙、丙三位同學分別設計了下列三套實驗裝置:

請從甲、乙兩位同學設計的裝置中選擇一種作為實驗室制取乙酸乙酯的裝置,我選擇的裝置是 (選填 “甲”或 “乙”)。丙同學將甲裝置中的玻璃管改成了球形干燥管除起冷凝作用外,它的另一重要作用是 。
【問題討論】
a.根據試管②中觀察到的現象,可知乙酸乙酯的物理性質有:
無色油狀液體、 、 ;
b.試管②中飽和 Na2CO3 溶液的作用是 (填編號)。
A.溶解乙醇 B.降低乙酸乙酯的溶解度 C.中和乙酸
c.從試管②中分離出乙酸乙酯的實驗操作是 。
d.生成乙酸乙酯的化學反應方程式 。
e.乙醇在銅或銀作催化劑時,可以被氧化為一種有刺激性氣味的物質,寫出該反應的化學反應方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[化學-選修3:物質結構與性質]
鐵銅是人類最早大規模使用的金屬,它們的化合物在科學研究和工業生產中具有許多用途。請回答以下問題:
(1)鐵元素在周期表中的位置是 ,銅的基態原子核外電子排布式為 ,元素鐵與銅的第二電離能分別為:ICu=1958 kJ·mol-1、IFe=1561 kJ·mol-1,ICu比IFe大得多的原因是 。
(2)二茂鐵[Fe(C5H5)2],橙色晶型固體,有類似樟腦的氣味,抗磁性。熔點172.5~173℃,100℃以上升華,沸點249℃。據此判斷二茂鐵晶體類型為______________。
(3)藍礬(CuSO4·5H2O)的結構如下圖所示:
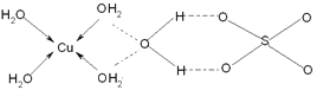
圖中虛線表示_____________,SO42-的立體構型是__________,其中S原子的雜化軌道類型是___________;O原子的價電子排布圖為__________________。
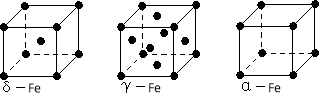
(4)鐵有δ、γ、α三種同素異形體,下圖是它們的晶體結構圖,三種晶體中鐵原子周圍距離最近的鐵原子個數之比為 。
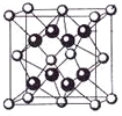
(5)某種具有儲氫功能的銅合金晶體具有立方最密堆積的結構,晶胞中Cu原子處于面心,Au原子處于頂點位置,該晶體中原子之間的作用力是_______________。氫原子可進入到由Cu原子與Au原子構成的四面體空隙中。若將Cu原子與Au原子等同看待,該晶體儲氫后的晶胞結構與 CaF2的結構(晶胞結構如右圖)相似,該晶體儲氫后的化學式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有下列九種物質:① H2 ② 鋁 ③ CuO ④ CO2 ⑤ NaHSO4 ⑥ Ba(OH)2固體 ⑦ 氨水 ⑧ 稀硝酸 ⑨ 熔融Al2(SO4)3。
(1)上述狀態下可導電的是____________;屬于電解質的是____________;屬于非電解質的是______________。(填序號)
(2)寫出⑤、⑨在水中的電離方程式 、 。
(3)34.2 g ⑨溶于水配成250 mL溶液,SO![]() 的物質的量濃度為___________。
的物質的量濃度為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室可用KMnO4和濃鹽酸反應制取氯氣。
KMnO4+HCl(濃)=KCl+MnCl2+Cl2↑+H2O(未配平)
(1)配平化學方程式,并用單線橋標出電子轉移的方向和數目。
(2)將上述配平的化學方程式改寫為離子方程式 。
(3)濃鹽酸在反應中顯示出來的性質是________________
①只有還原性 ②還原性和酸性
③只有氧化性 ④氧化性和酸性
(4)若產生0.5molCl2,則被氧化的HCl mol,轉移的電子的數目約為___________。
(5)一定條件下,KMnO4還可以氧化其他還原性物質。
MnO4-+C2O42-+ = Mn2+ +CO2↑+
完成上述離子方程式,此反應中,發生氧化反應的物質是 ;若轉移1mol電子,生成標準狀況下CO2 L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25 ℃時,AgCl的白色懸濁液中,依次加入等濃度的KI溶液和Na2S溶液。觀察到的現象是先出現黃色沉淀,最終出現黑色沉淀。已知有關物質的溶度積Ksp (25 ℃)如下:
AgCl | AgI | Ag2S | |
Ksp | 1.8×10-10 | 8.51×10-16 | 6.3×10-50 |
下列敘述錯誤的是
A.沉淀轉化的實質就是沉淀溶解平衡的移動
B.溶解度小的沉淀可以轉化為溶解度更小的沉淀
C.AgCl固體在等物質的量濃度的NaCl、CaCl2溶液中的溶解程度相同
D.25 ℃時,在飽和AgCl、AgI、Ag2S溶液中,所含Ag+的濃度不同
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com