
【題目】氧化鎂是優良的阻燃劑,同時在醫藥、建筑等行業的應用也十分廣泛。用硫酸鎂還原熱解制備高純氧化鎂是一種新的探索。以菱鎂礦(主要成分為MgCO3,含少量SiO2、FeCO3等)為原料制備高純氧化鎂的實驗流程如下:

已知在水溶液中生成氫氧化物沉淀的pH:
Mg(OH)2 | Fe(OH)2 | Fe(OH)3 | |
開始沉淀時 | 9.4 | 7.6 | 1.5 |
完全沉淀時 | 10.4 | 9.7 | 2.8 |
(1)菱鎂礦酸溶前需要粉碎,目的是_______________。
(2)加入H2O2氧化時,發生反應的離子方程式為______________________。
(3)加氨水調節溶液的pH范圍為________ ,濾渣2 的主要成分是____________(填化學式)。
(4)流程圖中在獲得濾渣2的“過濾”與“煅燒”之間要經過的操作步驟為_______、過濾等操作,得到MgSO4·xH2O晶體。
(5)已知煅燒12.3gMgSO4·xH2O晶體得到2gMgO,則x值為_____________。
【答案】提高酸溶速率 2Fe2++H2O2 + 2H+=2Fe3++ 2H2O 2.8<pH<9.4 Fe(OH)3 蒸發濃縮、冷卻結晶 7
【解析】
菱鎂礦(主要成分為MgCO3,含少量SiO2、FeCO3等)加入硫酸,碳酸鎂和碳酸亞鐵溶解生成對應的鎂離子和亞鐵離子,二氧化硅不溶于硫酸,過濾得到濾渣1為二氧化硅。濾液中加入過氧化氫,氧化亞鐵離子生成鐵離子,再加入氨水調節溶液的pH,生成氫氧化鐵沉淀,過濾得濾渣2為氫氧化鐵,濾液經過一系列過程最后煅燒生成氧化鎂。
(1)菱鎂礦粉碎是為了增大接觸面積,提高酸溶速率。
(2)亞鐵離子被過氧化氫氧化,離子方程式為:2Fe2++H2O2 + 2H+=2Fe3++ 2H2O;
(3)調節溶液的pH,使鐵離子沉淀,但鎂離子不能沉淀,根據表格數據分析,pH范圍為2.8<pH<9.4,濾渣2的主要成分為 Fe(OH)3。
(4)要得到硫酸鎂晶體,需要將濾液進行蒸發濃縮、冷卻結晶,過濾,洗滌,干燥得到硫酸鎂晶體。
(5) MgSO4·xH2O----MgO
120+18x 40
12.3 2
則有![]() ,計算x=7。
,計算x=7。


科目:高中化學 來源: 題型:
【題目】下列反應既不屬于氧化還原反應,又是吸熱反應的是( )
A. 鋁片與稀鹽酸的反應 B. Ba(OH)28H2O與NH4Cl的反應
C. 生石灰與水反應 D. 甲烷在氧氣中的燃燒反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,夾子開始處于關閉狀態,將液體A滴入試管②與氣體B充分反應,打開夾子,可發現試管①內的水立刻沸騰了。則液體A和氣體B的組合不可能
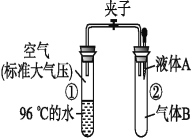
A. NaOH溶液、CO2
B. H2O、氨氣
C. NaOH溶液、CO
D. H2O、NO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知化學反應①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化學平衡常數為K1;化學反應②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化學平衡常數為K1;化學反應②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化學平衡常數為K2,在溫度973 K和1173 K的情況下,K1、K2的值分別如下:
FeO(s)+H2(g),其化學平衡常數為K2,在溫度973 K和1173 K的情況下,K1、K2的值分別如下:
溫度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通過表格中的數值可以推斷:反應①是_______(填“吸熱”或“放熱”)反應。
(2)現有反應③:CO2(g)+H2(g)![]() CO(g)+H2O(g),請你寫出該反應的平衡常數K3的表達式:K3=______。
CO(g)+H2O(g),請你寫出該反應的平衡常數K3的表達式:K3=______。
(3)根據反應①與②可推導出K1、K2與K3之間的關系式為__________,據此關系式及上表數據,能推斷出反應③是________(填“吸熱”或“放熱”)反應。
(4)要使反應③在一定條件下建立的平衡向正反應方向移動,可采取的措施有______ 、_____ (填寫字母序號)。
A.縮小反應容器的容積 B.擴大反應容器的容積
C.升高溫度 D.使用合適的催化劑
E.設法減小平衡體系中的CO的濃度
(5)圖甲、乙分別表示反應③在t1時刻達到平衡,在t2時刻因改變某個條件而發生變化的情況:
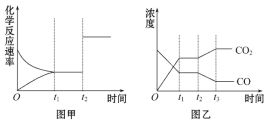
①圖甲中t2時刻發生改變的條件是__________。
②圖乙中t2時刻發生改變的條件是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示的裝置是某次實驗最初的情況(夾持裝置省略),燒瓶內盛有等體積的甲烷和氯氣,用光照射燒瓶一段時間,下列說法正確的是( )
![]()
A. 只能生成CH3Cl一種有機物
B. 燒瓶內液面不可能上升
C. 大試管內的液體可能會分層
D. 向水中加入石蕊試液后不變色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為檢驗淀粉水解的情況,進行如圖所示的實驗,試管甲和丙均用60~80℃的水浴加熱5~6min,試管乙不加熱。
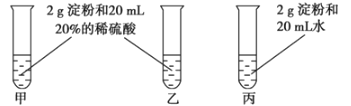
待試管甲中的溶液冷卻后再進行后續實驗。
實驗①:取少量甲中溶液,加入新制氫氧化銅,加熱,沒有磚紅色沉淀出現。
實驗②:取少量乙中溶液,滴加幾滴碘水,溶液變為藍色,但取少量甲中溶液做此實驗時,溶液不變藍色。
實驗③:取少量丙中溶液加入氫氧化鈉溶液調節至堿性,再滴加碘水,溶液顏色無明顯變化。
(1)寫出淀粉水解的化學方程式_____________________。
(2)設計甲和乙是為了探究________對淀粉水解的影響,設計甲和丙是為了探究________對淀粉水解的影響。
(3)實驗①失敗的原因是_____________________________。
(4)實驗③中溶液的顏色無明顯變化的原因是______________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com