
【題目】某有機物在氧氣中充分燃燒,生成CO2和H2O的物質的量之比為1:2,則該有機物
A.一定含有C、H、O三種元素B.分子中C、H原子個數之比為1:4
C.只含有C、H兩種元素D.最簡式為CH4
 全能測控期末小狀元系列答案
全能測控期末小狀元系列答案科目:高中化學 來源: 題型:
【題目】2017年5月18日,中國國土資源部地質調查局宣布,我國在南海進行的可燃冰試采獲得成功,成為全球第一個海域試采可燃冰成功的國家,可燃冰即天然氣水合物,甲烷含量占80%至99.9%。化工生產中用甲烷和水蒸氣反應得到以CO和H2為主的混合氣體,這種混合氣體可用于生產甲醇或合成氨,回答下列問題:
(1)對甲烷而言,有如下兩個主要反應:
①CH4(g)+1/2O2(g)=CO(g)+2H2(g) △H1 =-36kJ·mol-1
②CH4(g)+H2O(g)=CO(g)+3H2(g) △H2 =+216kJ·mol-1
若不考慮熱量耗散,物料轉化率均為100%,最終爐中出來的氣體只有CO、H2,為維持熱平衡,每生產lmolCO,轉移電子的數目為__________。
(2)甲醇是一種用途廣泛的化工原料,工業上常用下列兩種反應制備甲醇:
CO(g)+2H2(g)=CH3OH(g) △H1 =-90kJ·mol-1 K1
CO2(g)+3H2(g)= CH3OH(g)+H2O(l) △H2 K2
己知:CO(g)+H2O(g)= CO2(g)+H2(g) △H3 =-41.1kJ·mol-1 K3
H2O(l)=H2O(g) △H4 =+44.0kJ·mol-1 K4
則△H2=______ K2=_______ (用含K1、K3、K4的代數式表示)
(3)在一恒溫恒容密閉容器中充入1molCO2和3molH2模擬工業合成甲醇的反應:CO2(g)十3H2(g) ![]() CH3OH(g)十H2O(g)
CH3OH(g)十H2O(g)
①下列能說明該反應已達到平衡狀態的是______________________。
A.混合氣體平均相對分子質量不變 B.混合氣體密度不變
C.容器內壓強恒定不變 D.反應速率滿足以下關系:V正(CO2)=3V逆(H2)
E.CO2、H2、CH3OH、H2O物質的量濃度之比為1:3:1:1
F.單位時間內斷裂3NAH-H鍵的同時形成2molH-O鍵
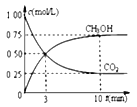
②模擬過程中測得CO2和CH3OH(g)濃度隨時間變化如圖所示,若此時容器內壓強為P,則用平衡分壓代替平衡濃度表示的化學平衡常數KP為_____________(用含P的代數式表示,數值保留兩位小數),若此時再向容器內充入0.25molCO2和0.25molCH3OH的混合氣體,則平衡______(填“正向“逆向“不”)移動。(已知:氣體分壓=氣體總壓×體積分數)
(4)甲醇可在電解銀催化作用下制甲醛,從貴金屬陽極泥中可提取“粗銀”“粗銀”(含Ag、Cu、Au)可用電解槽電解精煉,純銀作陰極,采用AgNO3和稀HNO3的混合液作電解液,陰極的主要電極反應式為_____。陰極還有少量副反應發生,產生的氣體遇空氣迅速變為紅棕色,該副反應的電極反應式為_______。硝酸濃度不能過大,其原因是___________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關說法不正確的是( )
A.苯與濃硝酸、濃硫酸共熱并保持50~60℃反應生成硝基苯
B.在甲苯中加入少量酸性高錳酸鉀溶液,振蕩后褪色,正確的解釋是由于苯環對側鏈的影響,使側鏈易被氧化
C.若甲苯苯環上的一個氫原子被一個含3個碳原子的烷基取代,所得產物有6種
D.菲的結構簡式為 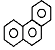 ,它與硝酸反應,可生成3種一硝基取代物
,它與硝酸反應,可生成3種一硝基取代物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用海水可以提取溴和鎂,提取過程如下:
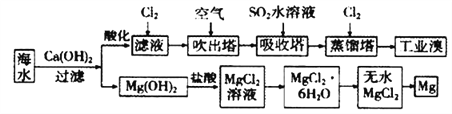
(1)提取溴的過程中,經過2次Br-→Br2轉化的目的是________,吸收塔中發生反應的離子方程式是________________。
(2)據上述流程,將10m3海水中溴元素(海水中Br-離子含量為64mg/L)轉化為工業溴,整個流程中至少需要標準狀況下Cl2的體枳為______L(忽略Cl2溶解)。
(3)從理論上考慮,下列物質也能吸收Br2的是_____。
A.H2O B.FeCl2 C.Na2SO3
(4)由無水氯化鎂得到鎂的化學方程式是_______。
(5)有同學認為:可以加熱Mg(OH)2得到MgO,再電解熔融的MgO制金屬鎂,以簡化實驗步驟,體現實驗的簡約性原則,你是否同意該同學的觀點,理由為_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與生活息息相關.下列敘述正確的是( )
A.鮮榨橙汁遇到碘水會變藍
B.饅頭越嚼越甜
C.油脂經堿性水解可制得肥皂
D.土豆中的淀粉經水解可變成酒
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質:HCHO(甲醛)、MgSO4、NH4Cl、Hg(NO3)2中,能使蛋白質變性的是( )
A.甲醛
B.MgSO4
C.NH4Cl
D.Hg(NO3)2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以硼鎂泥為原料制取的硫酸鎂可用于印染、造紙、醫藥等工業。硼鎂泥是一種工業廢料,主要成分是MgO(占40%),還有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等雜質。從硼鎂泥中提取MgSO4·7H2O的流程如下:

(1)實驗中需用3 mol·L-1的硫酸500 mL,若用98%的濃硫酸(ρ=1.84 g·mL-1)來配制,量取濃硫酸時,需使用的量筒的規格為 ________(填字母)。
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可與Mn2+反應,方程式為Mn2++ClO-+H2O===MnO2↓+2H++Cl-,
欲使2moL Mn2+被氧化則至少需要氧化劑NaClO質量為______g;還有一種離子也會被NaClO氧化,該反應的離子方程式為______________________________________。
(3)濾渣的主要成分除含有Fe(OH)3、Al(OH)3外,還含有________、_________。
(4)在“除鈣”步驟前,若要檢驗混合液中是否還存在Fe2+,簡述檢驗方法:_____________________________________。
(5)已知MgSO4、CaSO4的溶解度如下表(溶解度單位為g/100 g水):
溫度/℃ | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除鈣”是將MgSO4和CaSO4混合溶液中的CaSO4除去,根據上表數據,簡要說明除鈣的操作步驟:蒸發濃縮、_________。“操作Ⅰ”是將濾液繼續蒸發濃縮,冷卻結晶,__________,便得到了MgSO4·7H2O。
(6)若實驗中提供的硼鎂泥共100 g,得到的MgSO4·7H2O為86.1 g,則MgSO4·7H2O的產率為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】依據氧化還原反應:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)設計的原電池如圖所示。請回答下列問題:

(1)電極X的材料是________;電解質溶液Y是_________;
(2)銀電極為電池的________極,發生的電極反應為__________________;X電極上發生的電極反應為________________________;
(3)外電路中的電子是從_______電極流向________電極。
(4)若電極X質量減少6.4g,則Ag極質量增加______ g.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com