
【題目】已知:從石油中獲得A是目前工業上生產A的主要途徑,A的產量通常用來衡量一個國家的石油化工發展水平。現以A為主要原料合成乙酸乙酯,其合成路線如圖所示。
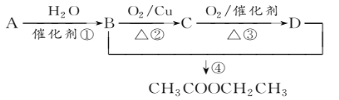
回答下列問題:
(1)寫出A的結構簡式______________。
(2)B、D分子中的官能團名稱分別是_______________、________________。
(3)寫出下列反應的反應類型:①_________,②________,④__________。
(4)寫出下列反應的化學方程式:
①________________________________________________________________;
②________________________________________________________________。
③________________________________________________________________。
【答案】CH2=CH2 羥基 羧基 加成反應 氧化反應 酯化反應(或取代反應) CH2=CH2+H2O![]() CH3CH2OH 2CH3CH2OH+O2
CH3CH2OH 2CH3CH2OH+O2![]() 2CH3CHO+2H2O CH3CH2OH + CH3COOH
2CH3CHO+2H2O CH3CH2OH + CH3COOH![]() CH3COOCH2CH3+ H2O
CH3COOCH2CH3+ H2O
【解析】
由信息可知A為CH2=CH2,結合合成路線圖可知,A與水發生加成反應生成B為CH3CH2OH,B發生氧化反應生成C為CH3CHO,C發生氧化反應生成D為CH3COOH,B與D發生酯化反應生成CH3COOCH2CH3,以此解答該題。
(1)由以上分析可知A為CH2═CH2;
答案為:CH2═CH2。
(2)B為CH3CH2OH,B中官能團為羥基,D為CH3COOH,D中官能團為羧基;
答案為羥基、羧基。
(3)反應①的反應類型為加成反應、,②的反應類型為氧化反應,④的反應類型為酯化反應(或取代反應);
答案為加成反應,氧化反應,酯化反應(或取代反應);
(4)①乙烯與水發生加成反應生成乙醇,方程式為CH2═CH2+H2O![]() CH3CH2OH;
CH3CH2OH;
答案為CH2═CH2+H2O![]() CH3CH2OH。
CH3CH2OH。
②乙醇發生催化氧化生成乙醛,方程式為2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
答案為2CH3CH2OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。
③乙酸與乙醇發生酯化反應,方程式為CH3CH2OH + CH3COOH![]() CH3COOCH2CH3+ H2O;
CH3COOCH2CH3+ H2O;
答案為CH3CH2OH + CH3COOH![]() CH3COOCH2CH3+ H2O。
CH3COOCH2CH3+ H2O。


 考前必練系列答案
考前必練系列答案科目:高中化學 來源: 題型:
【題目】完成下列各小題。
Ⅰ.按要求書寫下列化學方程式
(1)2-甲基-1,3-丁二烯與等物質的量的溴發生1,4-加成的反應:_______。
(2)乙醛與新制氫氧化銅懸濁液加熱反應:______。
(3)CH3CHClCOOCH2CH3與氫氧化鈉水溶液共熱:____。
(4)乙二醇和乙二酸脫水成環酯:_____。
Ⅱ.有一種有機物X的鍵線式如圖所示。
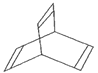
(5)X的分子式為________。
(6)有機物Y是X的同分異構體,且屬于芳香族化合物,則Y的結構簡式是____。
(7)Y在一定條件下可生成高分子化合物,該反應的化學方程式是___。
(8)X與足量的H2在一定條件下反應可生成環狀的飽和烴Z,Z的一氯代物有____種。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國每年產生的廢舊鉛蓄電池約330萬噸。從含鉛廢料(含PbSO4、PbO2、PbO等)中回收鉛,實現鉛的再生,意義重大。一種回收鉛的工藝流程如下:
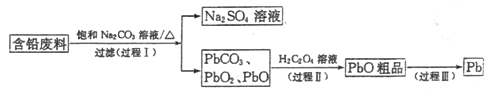
(1)鉛蓄電池放電時,PbO2作____極。
(2)過程I,已知:PbSO4、PbCO3的溶解度(20℃)見圖l;Na2SO4、Na2CO3的溶解度見如圖。
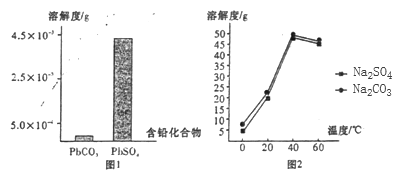
①根據圖l寫出過程I的離子方程式:__________。
②生產過程中的溫度應保持在40℃,若溫度降低,PbSO4的轉化速率下降。根據如圖,解釋可能原因:
i.溫度降低,反應速率降低; ii.______________(請你提出一種合理解釋)。
(3)①過程Ⅱ,發生反應2PbO2+H2C2O4=2PbO+H2O2+2CO2↑。實驗中檢測到有大量O2放出,推測PbO2氧化了H2O2,通過實驗證實了這一推測。實驗方案是___________。
(已知:PbO2為棕黑色固體;PbO為橙黃色固體)
②寫出H2O2的電子式__________。
(4)過程Ⅲ,將PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的電解液,電解Na2PbCl4溶液,生成Pb,如圖。
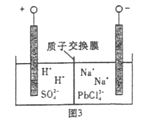
①陰極的電極反應式是____________。
②電解一段時間后,PbCl42-濃度極大下降,為了恢復其濃度且實現物質的循環利用,陰極區采取的方法是_______。
(5)如果用鉛蓄電池作電源電解飽和食鹽水制取Cl2,已知某鉛蓄電池中硫酸溶液的體積為0.8L,電解其按硫酸濃度為4.5mol/L,當制得26.88L Cl2時(指在標準狀況下),求理論上電解后電池中硫酸溶液的濃度為________ mol·L-1。(假設電解前后硫酸溶液的體積不變)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列對某未知溶液中離子的檢驗方法及其結論一定正確的是( )
A.加入稀鹽酸產生無色氣體,一定含有![]()
B.加入氯化鋇溶液產生白色沉淀,一定含有![]()
C.加入碳酸鈉溶液產生白色沉淀,一定含有Ca2+
D.取溶液進行焰色反應顯黃色,一定含有Na+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了科學飲食,了解一些與食品相關的化學知識是必要的。
(1)油炸蝦條、薯片等容易擠碎的食品,不宜選用真空袋裝,而應采用充氣袋裝。下列氣體中不應該充入的是________(填序號,下同)。
A.氮氣 B.二氧化碳
C.空氣 D.氧氣
(2)為使以面粉為原料的面包松軟可口,通常用碳酸氫鈉作發泡劑,因為它________。
A.熱穩定性差 B.增加甜味
C.產生二氧化碳 D.提供鈉離子
(3)能直接鑒別氯化鈉和葡萄糖兩種未知濃度溶液的方法是________。
A.觀察顏色 B.測量比值
C.加熱灼燒 D.分別聞味
(4)苯甲酸鈉是常用的食品防腐劑,其結構簡式如圖。以下對苯甲酸鈉描述錯誤的是________。

A.屬于鹽類 B.能溶于水
C.屬于烴類 D.不易分解
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫鐵礦燒渣的主要成分為Fe2O3、Fe3O4,以及少量SiO2、Al2O3等。由硫鐵礦燒渣制備鐵紅(Fe2O3)的一種工藝流程如下:

已知:還原焙燒時,大部分Fe2O3、Fe3O4轉化為FeO。
幾種離子開始沉淀和完全沉淀時的pH如下表所示:
離子 | 開始沉淀時的pH | 完全沉淀時的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
(1)“酸浸、過濾”步驟中所得濾液中的金屬陽離子有(填離子符號)________________。
(2)Fe粉除調pH外,另一個作用是___________;Fe粉調節溶液的pH為__________。
(3)“沉淀、過濾”步驟中生成FeCO3的離子方程式為_______________________________;
所得濾液的主要溶質是(填化學式)_______________。
(4)高溫條件下,“氧化”步驟中發生反應的化學方程式為______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,請回答有關問題:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)第2周期的8種元素中,第一電離能介于①元素和③元素間的元素有__種。
(2)表中能形成兩性氫氧化物的元素是___(填元素名稱![]() ,寫出該元素的單質與⑨最高價氧化物的水化物反應的離子方程式___。
,寫出該元素的單質與⑨最高價氧化物的水化物反應的離子方程式___。
(3)②、⑤、⑦、⑨六種元素的最高價氧化物的水化物中,按堿性減弱酸性增強的順序排列為(用化學式表示)___。
(4)④元素與⑩元素兩者質子數之差是___。
(5)請寫出③的氣體氫化物發生催化氧化的化學方程式___。
(6)請寫出⑥元素的最高價氧化物的水化物與⑧元素的最高價氧化物的水化物反應的離子方程式___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物的結構式可用“鍵線式”簡化表示。如CH3一CH=CH一CH3可簡寫為![]() 。有機物X的鍵線式為:
。有機物X的鍵線式為: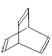 。下列說法不正確的是
。下列說法不正確的是
A.X與苯中碳元素的質量分數相同
B.有機物Y是X的同分異構體,且屬于芳香烴,能使溴水褪色,則Y為苯乙烯
C.X能使酸性高錳酸鉀溶液褪色
D.X 與足量的H2在一定條件下反應可生成環狀的飽和烴Z,Z的一氯代物有四種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.2019年是元素周期表發表150周年,期間科學家為完善周期表做出了不懈努力。中國科學院院士張青蓮教授曾主持測定了銦(49In)等9種元素相對原子質量的新值,被采用為國際新標準。
(1)In在周期表中的位置是___。
(2)In的最高價氧化物的水化物的堿性___Ba(OH)2的堿性(填“>”或“<”)。
(3)![]() In的中子數與電子數的差值為___。
In的中子數與電子數的差值為___。
II.A+、B2-、C-、D、E、F3+分別表示含10個電子的六種粒子(離子或分子)。其中:
a.A+、B2-、F3+核外電子層結構相同
b.C-是由兩種元素組成的
C.D是兩種元素組成的四原子分子
d.E在常溫下是無色液體
e.往含F3+的溶液中滴加含C-的溶液至過量,先有白色沉淀生成,后白色沉淀消失
(4)C-的電子式:___。
(5)A+、B2-、F3+離子半徑由大到小的順序為___(用離子符號表示)。
(6)電子式表示A2B的形成過程___。
(7)含F3+的溶液中通入過量D,反應的離子方程式是___。
(8)A單質與E反應的離子方程式為___,生成的化合物中化學鍵的類型是___。
III.硒(34Se)是動物和人體所必需的微量元素之一,也是重要的工業原料,與氧同族。
(9)Se原子結構示意圖可表示為___。
(10)下列說法合理的是___。
a.SeO2既有氧化性又有還原性
b.濃硒酸可能具有強氧化性、脫水性
c.熱穩定性:H2Se<HCl<H2S
d.酸性:H2SeO4<HBrO4<HClO4
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com