
【題目】氧化鎂在醫藥、建筑等行業應用廣泛。硫酸鎂還原熱解制備高純氧化鎂是一種新的探索。以菱鎂礦(主要成分為MgCO3,另含少量雜質FeCO3和SiO2等)為原料制備高純氧化鎂的實驗流程如下:
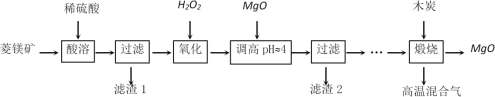
(1)酸溶時,MgCO3與稀硫酸反應的離子方程式為_____________________________。
(2)濾渣1的化學式為__________________。
(3)寫出流程中“氧化”的離子方程式為______________________________________。
(4)調節pH時,使用pH試紙的具體操作是取一小塊pH試紙放在潔凈的玻璃片上,_______________________________________________________;濾渣2中除了過量的MgO外,還含有的物質是____________。
(5)高溫煅燒過程中,同時存在以下反應:2MgSO4+C![]() 2MgO+2SO2↑+CO2↑;MgSO4+C
2MgO+2SO2↑+CO2↑;MgSO4+C![]() MgO+SO2↑+CO↑;MgSO4+3C高溫MgO+S↑+3CO↑。利用下圖裝置對煅燒產生的氣體進行連續分別吸收或收集(其中S蒸氣在A管中沉積)。
MgO+SO2↑+CO↑;MgSO4+3C高溫MgO+S↑+3CO↑。利用下圖裝置對煅燒產生的氣體進行連續分別吸收或收集(其中S蒸氣在A管中沉積)。
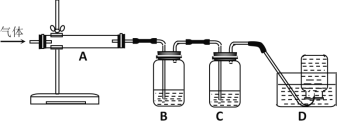
①D中收集的氣體是_________________(填化學式)。
②B中盛放的溶液是__________________(填下列選項的字母編號)。
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d.酸性KMnO4溶液
【答案】MgCO3+2H+=Mg2++CO2↑+H2O SiO2 2Fe2++2H++H2O2=2Fe3++2H2O 用潔凈干燥的玻璃棒蘸取待測溶液點在試紙的中部,再與比色卡對照得出讀數 Fe(OH)3 CO d
【解析】
以菱鎂礦(主要成分為MgCO3,另含少量雜質FeCO3和SiO2等)為原料,加入稀硫酸酸溶過濾得到濾液為硫酸鎂、硫酸亞鐵溶液,濾渣1為二氧化硅,濾液中加入過氧化氫,亞鐵離子被氧化為鐵離子,加入氧化鎂調節溶液pH沉淀鐵離子,過濾得到濾渣2為氫氧化鐵沉淀,濾液為硫酸鎂溶液,蒸發濃縮,冷卻結晶,過濾洗滌得硫酸鎂,硫酸鎂和木炭高溫煅燒制備高純氧化鎂,據此解答。
(1)MgCO3與稀硫酸反應生成硫酸鎂、二氧化碳和水,反應的離子方程式為MgCO3+2H+=Mg2++CO2↑+H2O;
(2)二氧化硅不溶于稀硫酸,則濾渣1的化學式為SiO2;
(3)加入H2O2氧化時,在酸性溶液中氧化硫酸亞鐵,反應的離子方程式為2Fe2++2H++H2O2=2Fe3++2H2O;
(4)調節pH時,使用pH試紙的具體操作是取一小塊pH試紙放在潔凈的玻璃片上,用潔凈干燥的玻璃棒蘸取待測溶液點在試紙的中部,再與比色卡對照得出讀數;調節pH時鐵離子轉化為氫氧化鐵沉淀,則濾渣2中除了過量的MgO外,還含有的物質是Fe(OH)3;
(5)根據方程式可知煅燒得到的氣體主要有SO2、CO2、CO、S,產生的氣體進行分步吸收或收集,所以通過A使硫蒸氣冷凝下來,再通過B裝置高錳酸鉀溶液吸收二氧化硫,通過C中的氫氧化鈉溶液吸收二氧化碳,最后剩余一氧化碳氣體在D中收集;
①CO難溶于水,D中收集的氣體可以是CO;
②裝置B吸收二氧化硫,由于二氧化碳、二氧化硫均與氫氧化鈉溶液、碳酸鈉溶液反應,稀硝酸能把二氧化硫氧化,但同時生成NO氣體,所以B中盛放的溶液選擇KMnO4溶液吸收二氧化硫,故答案為d。


 優學名師名題系列答案
優學名師名題系列答案科目:高中化學 來源: 題型:
【題目】下列說法中正確的是
A. 含有不同種元素的純凈物叫做化合物
B. 水溶液中能電離出H+的化合物一定是酸
C. 鹽中一定含有金屬元素
D. 非金屬氧化物一定是酸性氧化物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列說法正確的是( )
A.標準狀況下,11.2 L CH3CH2OH中含有的分子數目為0.5NA
B.14g分子式為CnH2n的鏈烴中含有的C-H鍵的數目為2NA
C.室溫時,1.0 L pH=13的Ba(OH)2溶液中含有OH-的數目為0.2NA
D.Fe與水蒸氣反應生成22.4L氫氣,轉移電子數為2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是________(填序號)。
①鋁和鹽酸、NaOH溶液的反應中,鋁作還原劑
②等質量的鋁與足量的鹽酸、NaOH溶液反應放出的H2物質的量相等
③等體積等物質的量濃度的鹽酸、NaOH溶液與過量的Al反應,產生H2的物質的量相等
④鋁與NaOH溶液反應中,每轉移3 mol e-,就生成1.5 mol H2
⑤化學方程式中各物質的化學計量數之比等于各物質的質量之比
⑥根據方程式2Na+2H2O===2NaOH+H2↑,可知2 mol Na與足量水反應放出22.4 L氫氣
⑦根據離子方程式Mg+2H+===Mg2++H2↑,可知1 g Mg與足量H+反應生成1 mol氫氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學上常用AG表示溶液中的lg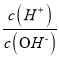 。25℃時,用0.100 molL-1的NaOH溶液滴定20.00 mL 0.100 molL-1的HNO2溶液,AG與所加NaOH溶液的體積(V)的關系如圖所示,下列說法正確的是
。25℃時,用0.100 molL-1的NaOH溶液滴定20.00 mL 0.100 molL-1的HNO2溶液,AG與所加NaOH溶液的體積(V)的關系如圖所示,下列說法正確的是
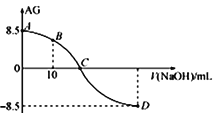
A. 滴定過程中,應選用甲基橙做指示劑
B. B點溶液中存在 c(H+)-c(OH-)=c(NO2-)-c(HNO2)
C. C點時,加入NaOH溶液的體積為20 mL
D. 25℃時,HNO2的電離常數Ka=1.0×10-4.5
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com