
【題目】鈷酸鋰(LiCoO2)電池是一種應用廣泛的新型電源,電池中含有少量的鋁、鐵、碳等單質。實驗室嘗試對廢舊鈷酸鋰電池回收再利用。實驗過程如下:
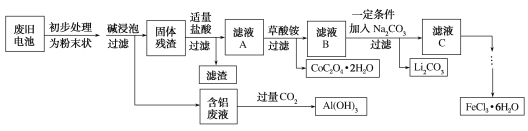
已知:①還原性:Cl->Co2+;
②Fe3+和![]() 結合生成較穩定的[Fe(C2O4)3]3-,在強酸性條件下分解重新生成Fe3+。回答下列問題:
結合生成較穩定的[Fe(C2O4)3]3-,在強酸性條件下分解重新生成Fe3+。回答下列問題:
(1)廢舊電池初步處理為粉末狀的目的是________。
(2)從含鋁廢液得到Al(OH)3的離子方程式為___________
(3)濾液A中的溶質除HCl、LiCl外還有________(填化學式)。寫出LiCoO2和鹽酸反應的化學方程式____________
(4)濾渣的主要成分為_______(填化學式)。
(5)在空氣中加熱一定質量的CoC2O4·2H2O固體樣品時,其固體失重率數據見下表,請補充完整表中問題。
已知:①CoC2O4在空氣中加熱時的氣體產物為CO2。
②固體失重率=對應溫度下樣品失重的質量/樣品的初始質量。
序號 | 溫度范圍/℃ | 化學方程式 | 固體失重率 |
Ⅰ | 120~220 | CoC2O4·2H2O CoC2O4+2H2O | 19.67% |
Ⅱ | 300~350 | ______ | 59.02% |
(6)已知Li2CO3的溶度積常數Ksp=8.64×10-4,將濃度為0.02 mol·L-1的Li2SO4和濃度為0.02 mol·L-1的Na2CO3溶液等體積混合,則溶液中的Li+濃度為________ mol·L-1。
【答案】增大接觸面積,加快反應速率,提高浸出率 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- FeCl3、CoCl2 2LiCoO2+8HCl=2CoCl2+Cl2↑+4H2O+2LiCl C 2CoC2O4+O2![]() 2CoO+ 4CO2 0.02
2CoO+ 4CO2 0.02
【解析】
(1)從反應物呈粉末狀接觸面積極大對反應的影響來回答;
(2)流程圖知含鋁廢液呈堿性,因此是偏鋁酸根溶液中通過量二氧化碳,寫得到Al(OH)3的離子方程式;
(3)濾液A的成分,從電池所含的物質與HCl反應來回答,當然要排除已轉移到堿液中的鋁元素; LiCoO2和鹽酸反應的化學方程式,結合信息判斷是氧化還原反應,按氧化還原反應規律書寫;
(4)濾渣的主要成分為廢電池總既不溶于酸又不溶于堿的成分;
(5) 補充完整表中問題,要從所提供的信息、數據,結合元素質量守恒定律計算得出;
(6)離子濃度的計算,先要用濃度是和KSP的關系判斷是否有碳酸鋰沉淀,如有沉淀,結合數據計算,如沒有沉淀,則就是混合溶液中離子的濃度;
廢舊鈷酸鋰鎳離子電池主要含有Fe、Al、碳的單質和LiCoO2,初步處理,加堿浸泡,鋁和堿液反應生成偏鋁酸鹽和氫氣,固體殘渣為:Fe、C的單質和LiCoO2,加鹽酸Fe+2H+=Fe2++H2↑,2LiCoO2+8H++2Cl-=2Li++2Co2++Cl2↑+4H2O,殘渣為C,濾液A為Fe3+、Li+、Co3+、Cl-,加入草酸銨,過濾沉淀為CoC2O42H2O,濾液B為:Fe3+、Li+、Cl-,加入碳酸鈉,發生的離子反應為2Li++CO32-=Li2CO3↓,濾液C為Fe3+、Cl-,加入氧化劑防止鐵離子被還原,得氯化鐵溶液;
(1)廢舊電池初步處理為粉末狀的目的是:增大接觸面積,加快反應速率,提高浸出率;
答案為:增大接觸面積,加快反應速率,提高浸出率;
(2) 偏鋁酸鈉溶液中通入過量二氧化碳反應生成氫氧化鋁沉淀和碳酸氫鈉,因此從含鋁廢液得到Al(OH)3的離子反應方程式為:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
答案為:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3) LiCoO2中Li為+1價,Co為+3價,具有氧化性,HCl中-1價的氯具有還原性,向固體殘渣中加入鹽酸時,發生氧化還原反應,Co(+3→+2),Cl(-1→0),反應表示為:2LiCoO2+8H++2Cl-=2Li++2Co2++Cl2↑+4H2O或2LiCoO2+8HCl=2CoCl2+Cl2↑+4H2O+2LiCl;,濾液A為Fe3+、Li+、Co3+、Cl-,故濾液A中的溶質為HCl、LiCl、FeCl3、CoCl2;
答案為:FeCl3、CoCl2;2LiCoO2+8HCl=2CoCl2+Cl2↑+4H2O+2LiCl;
(4)上述分析可知,濾渣的主要成分為C;
答案為:C;
(5) 在空氣中加熱一定質量的CoC2O4·2H2O固體樣品時,首先失去結晶水,在120~220℃時,固體失重率為19.76%,生成產物為CoC2O4;
由①可知,在120~220℃時,CoC2O4·2H2O完全失去結晶水生成CoC2O4,然后繼續升高溫度加熱,則CoC2O4分解生成氧化物,其分解失去的質量為183g×59.02%=108g,剩余的質量為183g-108g=75g,設產物的化學式為CoOx,則59+16x=75,解得x=1,則化學式為CoO,則反應方程式為:2CoC2O4+O2![]() 2CoO+ 4CO2;
2CoO+ 4CO2;
答案為:2CoC2O4+O2![]() 2CoO+ 4CO
2CoO+ 4CO
(6) 將濃度為0.02molL-1的Li2SO4和濃度為0.02molL-1的Na2CO3溶液等體積混合,混合瞬間溶液中c(Li+) =0.02mol/L,c(CO32-) =0.01mol/L,計算濃度商![]() =4×10-6<Ksp=8.64×10-4,無沉淀生成,則此時溶液中Li+濃度為0.02mol/L;
=4×10-6<Ksp=8.64×10-4,無沉淀生成,則此時溶液中Li+濃度為0.02mol/L;
答案為:0.02。


科目:高中化學 來源: 題型:
【題目】一瓶不純的K2CO3粉末,所含雜質可能是KNO3、Ca(NO3)2、KCl、CuCl2、Na2SO4中的一種或幾種。為確定其成分,進行如下實驗:
(1)取少量該粉末于燒杯中,加入適量蒸餾水,充分攪拌,得無色澄清溶液。
(2)在上述無色溶液中加入足量的BaCl2溶液,有白色沉淀生成,過濾,得無色溶液。
(3)取少許(2)中過濾后的無色溶液于試管中,滴加AgNO3溶液有白色沉淀生成。
下列說法正確的是( )
A.雜質中可能含有KNO3、CuCl2
B.雜質中肯定不含有Ca(NO3)2、CuCl2
C.雜質中肯定含有KCl、Na2SO4
D.雜質中肯定含有KCl,可能含有KNO3、Na2SO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲、乙是兩種常見的化合物,X、Y、Z是三種常見的單質。下表所列各組物質之間通過一步反應不能實現如圖所示轉化的是( )
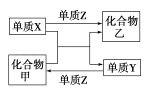
選項 | X | Y | Z | 甲 | 乙 |
A | C | H2 | O2 | H2O | CO |
B | Zn | Fe | Cl2 | FeCl2 | ZnCl2 |
C | Mg | C | O2 | CO2 | MgO |
D | H2 | Si | Cl2 | SiCl4 | HCl |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Y是合成香料、醫藥、農藥及染料的重要中間體,可由X在一定條件下合成:

下列說法不正確的是
A. Y的分子式為C10H8O3
B. 由X制取Y的過程中可得到乙醇
C. 一定條件下,Y能發生加聚反應和縮聚反應
D. 等物質的量的X、Y分別與NaOH溶液反應,最多消耗NaOH的物質的量之比為3∶2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. HF、HCl、HBr、HI的熔沸點依次升高
B. CH4、CCl4都是含有極性鍵的非極性分子
C. CS2、H2S、C2H2都是直線形分子
D. 氯的各種含氧酸的酸性由強到弱排列為HClO>HClO2>HClO3>HClO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】正硼酸(H3BO3)是一種片層狀結構白色晶體,有與石墨相似的層狀結構,受熱易分解,層內的H3BO3分子通過氫鍵相連(如圖所示),則下列有關說法中不正確的是

A. 正硼酸晶體屬于分子晶體
B. 正硼酸分子的穩定性與氫鍵無關
C. 1molH3BO3晶體中含有3mol氫鍵
D. B原子雜化軌道的類型sp2,層間的H3BO3分子通過共價鍵相連
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(雙選)下圖所示是晶體結構中具有代表性的最小重復單元(晶胞)的排列方式,其對應的化學式正確的是(圖中:![]() —X,
—X,![]() —Y,×—Z)( )
—Y,×—Z)( )
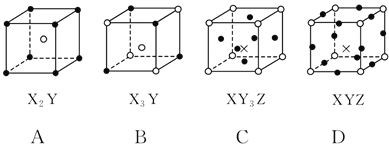
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下述轉化關系,回答問題:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物質苯環上一鹵代物只有兩種。
(1)寫出B物質的名稱__________;D物質的結構簡式________。
(2)寫出反應②的類型________;反應⑤的條件________。
(3)寫出反應⑥的化學方程式:________________________________。
(4)寫出D+E反應的化學方程式:_______________。
(5)反應②還有可能生成一種C16H18的有機物,其苯環上一鹵代物也只有兩種,寫出它的結構簡式:_______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】葡萄是一種常見水果,可以生食或制作葡萄干,除此之外,葡萄還可用于釀酒。
(1)檢驗葡萄汁含有葡萄糖的方法是:向其中加堿調至堿性,再加入新制的Cu(OH)2并加熱,其現象是________。
(2)葡萄在釀酒過程中,葡萄糖轉化為酒精的過程如下,補充完成下列化學方程式:C6H12O6(葡萄糖)![]() 2_________+ 2 C2H5OH
2_________+ 2 C2H5OH
(3)葡萄酒密封儲存過程中會生成有香味的酯類,酯類也可以通過化學實驗來制備,實驗室可用如圖所示裝置制備乙酸乙酯:

①試管a中生成乙酸乙酯的化學方程式是__________。
②試管b中盛放的試劑是飽和____________溶液。
③實驗開始時,試管b中的導管不伸入液面下的原因是________。
④若要分離出試管b中的乙酸乙酯,需要用到的儀器是_______(填字母)。
A.普通漏斗 B.分液漏斗 C.長頸漏斗
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com