
【題目】鐵在高溫條件下與氧化銅反應:2Fe+3CuO![]() Fe2O3+3Cu。銅在氯化鐵溶液中發生反應:Cu+2FeCl3=2FeCl2+CuCl2,一定質量的鐵與氧化銅的混合物,在高溫條件下恰好完全反應.將反應后的固體粉末倒入盛有足量稀鹽酸的燒杯中,振蕩,充分反應后靜置,然后從燒杯中取適量溶液(表示為“甲”)于試管中,并加入一定質量的鋅粉,充分反應后過濾,得到濾液乙和固體丙。下列判斷正確的是( )
Fe2O3+3Cu。銅在氯化鐵溶液中發生反應:Cu+2FeCl3=2FeCl2+CuCl2,一定質量的鐵與氧化銅的混合物,在高溫條件下恰好完全反應.將反應后的固體粉末倒入盛有足量稀鹽酸的燒杯中,振蕩,充分反應后靜置,然后從燒杯中取適量溶液(表示為“甲”)于試管中,并加入一定質量的鋅粉,充分反應后過濾,得到濾液乙和固體丙。下列判斷正確的是( )
①甲中含有FeCl3;②甲中不含FeCl3;③若向固體丙加稀鹽酸無明顯現象,則濾液乙中一定含有ZnCl2、FeCl2,可能含有CuCl2;④若向固體丙加稀鹽酸有氣體產生,則濾液乙中可能含有ZnCl2、FeCl2,一定不含有CuCl2。
A. ①③ B. ②③ C. ①④ D. ②④
【答案】B
【解析】
由信息提供的方程式中物質反應時的關系分析氯化鐵是否含有,根據甲的成分以及鹽溶液與金屬反應的規律分析濾液的成分。
鐵在高溫條件下與氧化銅反應2Fe+3CuO![]() Fe2O3+3Cu;銅在氯化鐵溶液中發生反應:Cu+2FeCl3=2FeCl2+CuCl2以及Fe2O3+6HCl=2FeCl3+3H2O可以建立以下關系式:Fe2O3~2FeCl3~Cu。根據鐵在高溫條件下與氧化銅反應2Fe+3CuO
Fe2O3+3Cu;銅在氯化鐵溶液中發生反應:Cu+2FeCl3=2FeCl2+CuCl2以及Fe2O3+6HCl=2FeCl3+3H2O可以建立以下關系式:Fe2O3~2FeCl3~Cu。根據鐵在高溫條件下與氧化銅反應2Fe+3CuO![]() Fe2O3+3Cu可知生成物質氧化鐵和銅的個數比是1:3,因此氯化鐵一定能完全被銅反應,所以甲中不含FeCl3,溶液中存在FeCl2和CuCl2,由于相關金屬的活動性順序是鋅>鐵>銅,所以放入鋅粒后鋅首先置換出銅,所以若向固體丙加稀鹽酸無明顯現象,說明固體不是鐵和鋅,所以濾液乙中一定含有ZnCl2、FeCl2,可能含有CuCl2,若向固體丙加稀鹽酸有氣體產生,可能是鋅(過量)或鐵和鋅(過量),因此溶液中不可能含有CuCl2,一定含有ZnCl2,可能含有FeCl2,綜上所述②③正確;答案選B。
Fe2O3+3Cu可知生成物質氧化鐵和銅的個數比是1:3,因此氯化鐵一定能完全被銅反應,所以甲中不含FeCl3,溶液中存在FeCl2和CuCl2,由于相關金屬的活動性順序是鋅>鐵>銅,所以放入鋅粒后鋅首先置換出銅,所以若向固體丙加稀鹽酸無明顯現象,說明固體不是鐵和鋅,所以濾液乙中一定含有ZnCl2、FeCl2,可能含有CuCl2,若向固體丙加稀鹽酸有氣體產生,可能是鋅(過量)或鐵和鋅(過量),因此溶液中不可能含有CuCl2,一定含有ZnCl2,可能含有FeCl2,綜上所述②③正確;答案選B。


 科學實驗活動冊系列答案
科學實驗活動冊系列答案科目:高中化學 來源: 題型:
【題目】閱讀材料,完成下列問題。
海底鹽池是近些年海洋科學家的一項重要發現,分布在世界多處埋有鹽層的海域,目前人類已探明的海底鹽池主要分布在紅海、地中海、墨西哥灣、黑海、南極大陸架。鹽池池面與普通海水之間有著清晰可見的分界。數不清的貝類與魚蝦在波光粼粼的鹽池周圍生活,但一旦生物進入鹽池內就會死亡。研究人員還從鹽池中采集了可以適應池中環境的生物樣本,分析之后認為這類生物可能會在太陽系中某一行星上生存,甚至可能在太陽系之外也會存在。
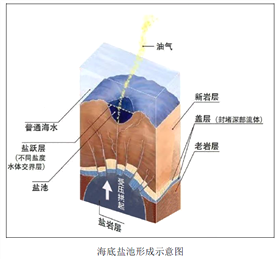

(1)結合材料,分析海底鹽池的形成條件。
(2)簡析池面與普通海水之間有明顯分界的原因。
(3)推測生物一旦進入這個海底鹽池就會死亡的原因。
(4)“海底鹽池”會受到哪些領域專家的關注,并簡述對“海底鹽池”開展科考的現實意
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在密閉容器中進行反應X2(g)+Y2(g)![]() 2Z(g),已知X2、Y2、Z的起始濃度分別為0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定條件下,當反應達到平衡時,各物質的濃度有可能是
2Z(g),已知X2、Y2、Z的起始濃度分別為0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定條件下,當反應達到平衡時,各物質的濃度有可能是
A. Z為0.2 mol·L-1 B. Y2為0.35 mol·L-1
C. X2為0.3 mol·L-1 D. Z為0.4 mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】含硫化合物在生產生活中應用廣泛,科學使用對人體健康及環境保護意義重大。
(1)紅酒中添加一定量的SO2 可以防止酒液氧化,這應用了SO2 的___性。
(2)某水體中硫元素主要以S2O32-形式存在,在酸性條件下,該離子會導致水體中有黃色渾濁并可能有刺激性氣味產生,原因是___________________________________。(用離子方程式說明)
(3)實驗室采用滴定法測定某水樣中亞硫酸鹽含量:
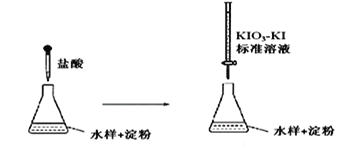
滴定時,KIO3 和KI 在鹽酸作用下析出I2:5I-+ IO3- + 6H+ =3I2+3H2O
生成的I2 再和水樣中的亞硫酸鹽反應:I2 + SO32- + H2O = 2H++2I-+ SO42-
①滴定到終點時的現象是:________________________________
②若滴定前盛標準液的滴定管沒有用標準液潤洗,則測定結果將_________(填“偏大、偏小、不變”)。
③滴定終點時,100mL的水樣共消耗x mL標準溶液。若消耗1mL標準溶液相當于SO32-的質量1g,則該水樣中SO32-的含量為__________g / L
(4)已知非金屬單質硫(S)是淡黃色固體粉末,難溶于水.為了驗證氯元素的非金屬性比硫元素的非金屬性強,某化學實驗小組設計了如下實驗,請回答下列問題:
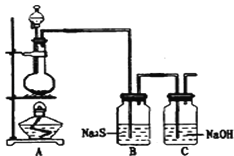
①若裝置A的圓底燒瓶中盛裝二氧化錳,則分液漏斗中盛裝的試劑是_____________________
②裝置B中實驗現象為___________________________,證明氯元素的非金屬性比硫元素的非金屬性強。
③裝置C中反應的作用是:____________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列指定反應的離子方程式正確的是
A. 電解熔融NaCl:2Cl-+2H2O ![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
B. 用氨水溶解AgCl沉淀:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O
C. Na2CO3溶液吸收溴蒸氣:3CO32-+Br2=Br-+BrO3-+3CO2
D. 金屬鈉與水反應:2Na+2H2O=2Na++2OH-+H2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向濕法煉鋅的電解液中同時加入Cu和CuSO4,可生成CuCl沉淀除去Cl—,降低對電解的影響,反應原理如下:
Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ΔH1=a kJ·mol-1
2Cu+(aq) ΔH1=a kJ·mol-1
Cl—(aq)+Cu+(aq)![]() CuCl(s) ΔH2=b kJ·mol-1
CuCl(s) ΔH2=b kJ·mol-1
實驗測得電解液pH對溶液中殘留c(Cl—)的影響如圖所示。下列說法正確的是

A. 溶液pH越大,Ksp(CuCl)增大
B. 向電解液中加入稀硫酸,有利于Cl-的去除
C. 反應達到平衡增大c(Cu2+),c(Cl—)減小
D. ![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl—(aq)
Cu2+(aq)+Cl—(aq)![]() CuCl(s)的ΔH=(a+2b) kJ·mol-1
CuCl(s)的ΔH=(a+2b) kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應屬于氧化還原反應的是:
A. NH3 + HCl = NH4Cl B. CuO + H2![]() Cu + H2O
Cu + H2O
C. CaCO3 ![]() CaO + CO2↑ D. H2SO4 + 2NaOH = Na2SO4 + 2H2O
CaO + CO2↑ D. H2SO4 + 2NaOH = Na2SO4 + 2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1,2-二溴乙烷可作抗爆劑的添加劑。如圖為實驗室制備1,2-二溴乙烷的裝罝圖, 圖中分液漏斗和燒瓶a中分別裝有濃H2SO4和無水乙醇,d裝罝試管中裝有液溴。
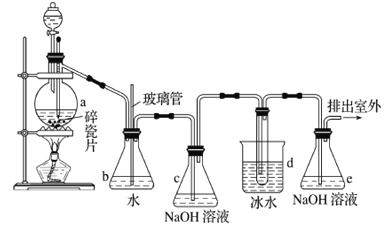
已知:CH3CH2OH![]() CH2=CH2↑+H2O;2CH3CH2OH
CH2=CH2↑+H2O;2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
相關數據列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
狀態 | 無色液體 | 無色液體 | 無色液體 | 紅棕色液體 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸點/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔點/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 難溶 | 微溶 | 可溶 |
(1)實驗中應迅速將溫度升高到170℃左右的原因是______________________________。
(2)安全瓶b在實驗中有多重作用。其一可以檢查實驗進行中d裝罝中導管是否發生堵塞,請寫出發生堵塞時瓶b中的現象:_______________________________;如果實驗時d裝罝中導管堵塞,你認為可能的原因是_______________________________________________;安全瓶b還可以起到的作用是__________________。
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是________________________________。
(4)除去產物中少量未反應的Br2后,還含有的主要雜質為___________,要進一步提純,下列操作中必需的是_____________ (填字母)。
A.重結晶 B.過濾 C.蒸餾 D.萃取
(5)實驗中也可以撤去d裝罝中盛冰水的燒杯,改為將冷水直接加入到d裝罝的試管中,則此時冷水除了能起到冷卻1,2-二溴乙烷的作用外,還可以起到的作用是____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對水垢的主要成分是CaCO3和Mg(OH)2而不是CaCO3和MgCO3的解釋,說法正確的是
A. Mg(OH)2的溶度積大于MgCO3的溶度積,且在水中發生了沉淀轉化
B. Mg(OH)2比MgCO3更難溶,且在水中發生了沉淀轉化
C. MgCO3電離出的CO![]() 發生水解,使水中OH-濃度減小,對Mg(OH)2沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀
發生水解,使水中OH-濃度減小,對Mg(OH)2沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀
D. 二者不能相互轉化
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com