
【題目】![]() 時,向
時,向![]() 中不斷滴入
中不斷滴入![]() ,混合溶液pH變化如圖所示。此過程溶液下列說法不正確的是
,混合溶液pH變化如圖所示。此過程溶液下列說法不正確的是![]() 已知:
已知:![]() 時一元酸
時一元酸![]() 電離平衡常數
電離平衡常數![]()
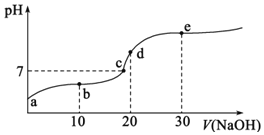
A.a點溶液的pH大于3
B.b點溶液中離子:![]()
C.c點表示酸![]() 和
和![]() 溶液恰好完全反應
溶液恰好完全反應
D.d點溶液加水稀釋后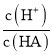 的值會增大
的值會增大
科目:高中化學 來源: 題型:
【題目】在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲線如圖所示,下列有關離子濃度關系的比較,正確的是

A. A、B之間任意一點,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. B點,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C. C點:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D. D點:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為電解飽和食鹽水裝置,下列有關說法不正確的是

A. 左側電極上發生氧化反應
B. 右側生成的氣體能使濕潤的淀粉碘化鉀試紙變藍
C. 電解一段時間后,B口排出NaOH溶液
D. 電解飽和食鹽水的離子方程式: 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】環己烯是重要的化工原料。其實驗室制備流程如下:
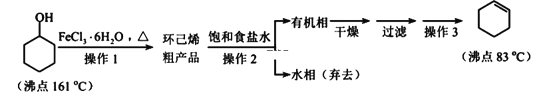
回答下列問題:
Ⅰ.環己烯的制備與提純
(1)原料環己醇中若含苯酚雜質,檢驗試劑為____________,現象為__________________。
(2)操作1的裝置如圖所示(加熱和夾持裝置已略去)。
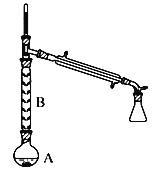
①燒瓶A中進行的可逆反應化學方程式為___________________,濃硫酸也可作該反應的催化劑,選擇FeCl36H2O而不用濃硫酸的原因為________________(填序號)。
a.濃硫酸易使原料炭化并產生SO2
b. FeCl36H2O污染小、可循環使用,符合綠色化學理念
c.同等條件下,用FeCl36H2O比濃硫酸的平衡轉化率高
②儀器B的作用為____________。
(3)操作2用到的玻璃儀器是____________。
(4)將操作3(蒸餾)的步驟補齊:安裝蒸餾裝置,加入待蒸餾的物質和沸石,____________,棄去前餾分,收集83℃的餾分。
Ⅱ.環己烯含量的測定
在一定條件下,向ag環己烯樣品中加入定量制得的bmolBr2,與環己烯充分反應后,剩余的Br2與足量KI作用生成I2,用cmolL-1的Na2S2O3標準溶液滴定,終點時消耗Na2S2O3標準溶液vml (以上數據均已扣除干擾因素)。
測定過程中,發生的反應如下:
①Br2+![]() →
→![]()
②![]()
③![]()
(5)樣品中環己烯的質量分數為___________(用字母表示)。
(6)下列情況會導致測定結果偏低的是____________(填序號)。
a.樣品中含有苯酚雜質
b.在測定過程中部分環己烯揮發
c. Na2S2O3標準溶液部分被氧化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值。下列說法正確的是
A.常溫下,1 mol濃硝酸與足量Al反應,轉移電子數為3NA
B.標準狀況下,5.6 L Cl2完全溶解于水配成1 L溶液,溶液中Cl-數為0.5NA
C.20 gH218O含有的中子數為10NA
D.1 L 0.5 mol·L-1 Al2(SO4)3溶液中陽離子所帶電荷數為3NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】燃煤煙氣的脫硫脫硝是目前研究的熱點。
(1)用CH4催化還原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJmol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJmol-1
③H2O(g)=H2O(l) △H=-44 kJmol-1
寫出CH4(g)與NO2(g)反應生成N2(g)、CO2(g)和H2O(l) 的熱化學方程式_________。
(2)某科研小組研究臭氧氧化--堿吸收法同時脫除SO2和NO工藝,氧化過程反應原理及反應熱、活化能數據如下:
反應Ⅰ:NO(g)+ O3(g) NO2(g)+O2(g) △H1= -200.9 kJmol-1Ea1= 3.2 kJmol-1
反應Ⅱ:SO2(g)+ O3(g) SO3(g)+O2(g)△H2= -241.6 kJmol-1 Ea2= 58 kJmol-1
已知該體系中臭氧發生分解反應:2O3(g) 3O2(g)。請回答:
其它條件不變,每次向容積為2L的反應器中充入含1.0 mol NO、1.0 mol SO2的模擬煙氣和2.0 mol O3,改變溫度,反應相同時間t后體系中NO和SO2的轉化率如圖所示:
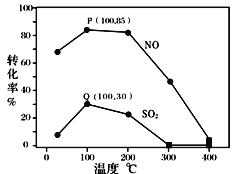
①由圖可知相同溫度下NO的轉化率遠高于SO2,結合題中數據分析其可能原因_______。
②下列說法正確的是 ____________ 。
A.P點一定為平衡狀態點
B.溫度高于200℃后,NO和SO2的轉化率隨溫度升高顯著下降、最后幾乎為零
C.其它條件不變,若縮小反應器的容積可提高NO和SO2的轉化率
③假設100℃時P(NO轉化率為85%)、Q(SO2轉化率為30%)均為平衡點,此時反應時間為10分鐘,發生分解反應的臭氧占充入臭氧總量的10%,則體系中剩余O3的物質的量是_______mol;NO的平均反應速率為_______________;反應Ⅱ在此時的平衡常數為_______________ 。
(3)用電化學法模擬工業處理SO2。將硫酸工業尾氣中的SO2通入如圖裝置(電極均為惰性材料)進行實驗,可用于制備硫酸,同時獲得電能:
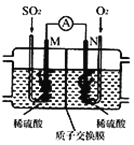
①M極發生的電極反應式為 ____________。
②當外電路通過0.2 mol電子時,質子交換膜左側的溶液質量_____(填“增大”或“減小”)_______克。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,將Cl2緩慢通入一定量的水中至飽和,然后向所得飽和氯水中逐滴加入0.1mol·L-1的氫氧化鈉溶液,整個過程中pH變化如圖所示,下列有關敘述正確的是
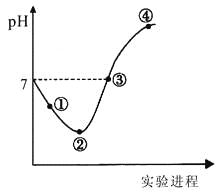
A.曲線起點處水的電離程度最大,可用pH試紙測定溶液pH
B.②點之前所發生反應的離子方程式為Cl2+H2O=2H++Cl-+ClO-
C.氯氣~氯水體系中:c(H+)=c(Cl2) +c(HClO)+c(ClO-)
D.③點所示溶液中:c(Na+) = c(Cl-)+c(ClO-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 時,用濃度為
時,用濃度為![]() 的NaOH溶液滴定
的NaOH溶液滴定![]() 相同濃度的HX溶液,滴定曲線如圖所示。下列說法正確的是
相同濃度的HX溶液,滴定曲線如圖所示。下列說法正確的是![]()
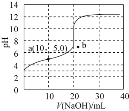
A.達到滴定終點時,溶液的![]()
B.根據圖象可估算出![]() 的值約為
的值約為![]()
C.a點所得溶液中:![]()
D.若用相同濃度的氨水替代NaOH溶液,滴定終點移向b點
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鹵代烴在生產生活中具有廣泛的應用,回答下列問題:
(1)有一種多氯代甲烷為常用有機溶劑,其分子結構為正四面體,它是______(寫化學式)
(2)聚四氟乙烯穩定、無毒,是不粘鍋的涂層,它的結構簡式是________________
(3)已知乙二酸俗名草酸,在工業上有廣泛的用途,根據下列合成路線填空:

分別寫出反應②③的化學反應方程式:________;_____________。
(4)按要求完成下列問題:在 ①苯 ②乙醇 ③甲苯 ④氯乙烷 ⑤![]() ⑥
⑥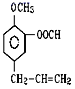 ⑦
⑦![]() 七種物質中(填編號):
七種物質中(填編號):
①能和金屬鈉反應放出H2的有________;
②常溫下能與溴水化學反應的有________;
③能使酸性KMnO4溶液褪色的有________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com