
【題目】四種短周期元素A、B、C、D原子序數依次遞增,原子半徑大小: B>C>D>A,四種元素之間兩兩形成的三種18電子結構的分子,它們的球棍模型及部分性質如下表:
甲 | 乙 | 丙 |
|
|
|
無色液體,具有強氧化性,可用作消毒劑 | 標況下密度約為1.34g/L,天然氣中的成分之一 | 液態,具有強還原性,用作火箭推進的燃料 |
(1)寫出化學式:甲___________、丙_____________。
(2)元素B核外有________種能量不同的電子,其形成的單質晶體可能是__________。
a.離子晶體 b.分子晶體 c.原子晶體 d.金屬晶體
(3)已知1g 液態丙與足量液態甲反應生成氮氣和水蒸氣,并放出20.05kJ的熱量,寫出反應的熱化學方程式________________。
(4)配平亞硫酸鈉和碘酸鉀在酸性溶液里反應的化學方程式:
____Na2SO3+___KIO3+___H2SO4____Na2SO4+____K2SO4+____I2+ ____H2O。
(5)該反應過程較復雜,一般認為分以下幾步:
①IO3-+SO32-IO2-+SO42-(反應慢)
②IO2-+2SO32-I-+2SO42-(反應快)
③5I-+6H++IO3-3I2+3H2O(反應快)
④I2+SO32-+H2O2I-+SO42-+2H+(反應快)
根據上述條件推測,此反應速率由________步(填序號)反應決定。
(6)若預先加入淀粉溶液,由反應過程看,必在_______離子消耗完時,才會有溶液變藍的現象產生。原因是_____________________。
【答案】H2O2 N2H4 3 bc N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.6kJ/mol 5、2、1、5、1、1、1 ① SO32- SO32-的還原性大于I-,可被I2氧化
【解析】
四種短周期元素A、B、C、D原子序數依次遞增,原子半徑大小:B>C>D>A,四種元素之間兩兩形成的三種18電子結構的分子,它們的球棍模型及部分性質如表,甲為液態,具有強氧化性,可用作消毒劑,則甲為H2O2;乙為天然氣的成分之一,在標況下密度約為1.34g·L-1,其摩爾質量為:1.34g·L-1×22.4L/m ol=30g/mol,結合球棍模型可知丙為乙烷;丙為液態,具有強還原性,用作火箭推進的燃料,則丙為N2H4;根據原子序數可知可知,A為H,B為C,C為N,D為O,據此解答。
(1)根據上述分析甲為H2O2,丙為N2H4,故答案為:H2O2;N2H4;
(2)元素B為C,核外有6個電子,分別位于1s、2s、2p軌道上,則有3種能量不同的電子,C元素形成的單質晶體可能為分子晶體、原子晶體,如C60、金剛石,不可能形成離子晶體和金屬晶體,故答案為:3;bc;
(3)1g液態丙(N2H4)與足量液態甲(H2O2)反應生成N2和H2O氣體,并放出20.05kJ的熱量,則1mol肼反應放出的熱量為:32×20.05=641.6(kJ),所以肼和過氧化氫反應的熱化學方程式為:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.6kJ/mol,故答案為:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.6kJ/mol;
(4)反應中S元素化合價由Na2SO3中+4價升高為+6價,總共升高2價,I元素化合價由KIO3中+5降低為I2中0價,總共降低10價,化合價最小公倍數為10,故Na2SO3系數為5,故I2系數為1,再結合原子守恒配平后方程式為5Na2SO3+2KIO3+H2SO4=5Na2SO4+K2SO4+I2+H2O,故答案為:5;2;1;5;1;1;1;
(5)由慢反應決定整個反應過程的速率,故反應速率由①步反應決定,故答案為:①;
(6)由反應④可知,SO32-的還原性大于I-,可被I2氧化,故需消耗完SO32-,才會生成I2,才會有溶液變藍的現象產生,故答案為:SO32-;SO32-的還原性大于I-,可被I2氧化。


 百年學典課時學練測系列答案
百年學典課時學練測系列答案 仁愛英語同步練習冊系列答案
仁愛英語同步練習冊系列答案科目:高中化學 來源: 題型:
【題目】已知![]() 的相對原子質量為34.969,下列相關說法正確的是( )
的相對原子質量為34.969,下列相關說法正確的是( )
A.氯元素的近似相對原子質量為35
B.氯元素的某種同位素的質量數為35
C.氯元素的中子數為18
D.氯原子的質量為34.969
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:
①Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) ΔH1
②2H2O(l)=2H2(g)+O2(g) ΔH2
③2H2O2(l)=2H2O(l)+O2(g) ΔH3
④Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH4
則ΔH4的正確表達式為( )
A.ΔH4=ΔH1+![]() ×ΔH2+
×ΔH2+![]() ×ΔH3B.ΔH4=ΔH1+
×ΔH3B.ΔH4=ΔH1+![]() ×ΔH2—
×ΔH2—![]() ×ΔH3
×ΔH3
C.ΔH4=ΔH1+2×ΔH2—2×ΔH3D.ΔH4=2×ΔH1+ΔH2+ΔH3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】葡萄是一種常見水果,可以生食或制作葡萄干,除此之外,葡萄還可用于釀酒。
(1)檢驗葡萄汁含有葡萄糖的方法是:向其中加堿調至堿性,再加入新制的Cu(OH)2并加熱,其現象是________。
(2)葡萄在釀酒過程中,葡萄糖轉化為酒精的過程如下,補充完成下列化學方程式:C6H12O6(葡萄糖)![]() 2_________+ 2 C2H5OH
2_________+ 2 C2H5OH
(3)葡萄酒密封儲存過程中會生成有香味的酯類,酯類也可以通過化學實驗來制備,實驗室可用如圖所示裝置制備乙酸乙酯:

①試管a中生成乙酸乙酯的化學方程式是__________。
②試管b中盛放的試劑是飽和____________溶液。
③實驗開始時,試管b中的導管不伸入液面下的原因是________。
④若要分離出試管b中的乙酸乙酯,需要用到的儀器是_______(填字母)。
A.普通漏斗 B.分液漏斗 C.長頸漏斗
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在相同溫度和壓強下,對反應CO2(g)+H2(g)![]() CO(g)+H2O(g)進行甲、乙、丙、丁四組實驗,實驗起始時放入容器內各組分的物質的量見下表
CO(g)+H2O(g)進行甲、乙、丙、丁四組實驗,實驗起始時放入容器內各組分的物質的量見下表
| CO2 | H2 | CO | H2O |
甲 | amol | amol | 0mol | 0mol |
乙 | 2amol | amol | 0mol | 0mol |
丙 | 0mol | 0mol | amol | amol |
丁 | amol | 0mol | amol | amol |
上述四種情況達到平衡后,n(CO)的大小順序是
A. 乙=丁>丙=甲B. 乙>丁>甲>丙
C. 丁>乙>丙=甲D. 丁>丙>乙>甲
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】核電站為防止發生核輻射事故,通常用含有鉛的水泥做成屏蔽罩,內襯鋼板,反應的壓力容器用鐵、銅等具有反輻射合金材料制成。
(1)水泥中通常含有碳、氧、硅、鋁等元素,則這四種元素的基態原子中3p能級上存在電子的有______(填元素符號)
(2)寫出二價銅離子的基態電子排布式:______
(3)鉛的核電荷數為82,寫出鉛原子的價電子排布式:______
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用酸堿滴定法可測定Ba2+的含量,實驗分兩步進行。
已知:2CrO42﹣(黃色)+ 2H+ → Cr2O72﹣(橙紅色)+ H2O Ba2+ + CrO42﹣ → BaCrO4↓
步驟Ⅰ:移取x mL一定濃度的Na2CrO4溶液于錐形瓶中,加入酸堿指示劑,用b molL﹣1鹽酸標準液滴定至終點,測得滴加鹽酸體積為V0 mL。
步驟Ⅱ:移取y mL BaCl2溶液于錐形瓶中,加入x mL與步驟Ⅰ相同濃度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸堿指示劑,用b molL﹣1鹽酸標準液滴定至終點,測得滴加鹽酸的體積為V1mL,BaCl2溶液的濃度為_________________mol/L(含x、y的表達式),若步驟Ⅱ 中滴加鹽酸時有少量待測液濺出,Ba2+濃度測量值將___________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】扎來普隆是一種短期治療失眠癥的藥物,其合成路線如下:
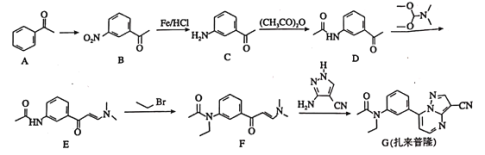
回答下列問題:
(1)A中的官能團名稱是________________。
(2)![]() 所需的試劑和條件分別為________________。
所需的試劑和條件分別為________________。
(3)![]() 、
、![]() 的反應類型依次為________、________。
的反應類型依次為________、________。
(4)扎來普隆的分子式為________________。
(5)![]() 的化學方程式為________________________。
的化學方程式為________________________。
(6)屬于芳香化合物,且含有硝基,并能發生銀鏡反應的B的同分異構體有________種(不考慮立體異構),其中核磁共振氫譜有4組峰的結構簡式有________________。
(7)已知:![]() 有堿性且易被氧化。設計由
有堿性且易被氧化。設計由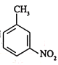 和乙醇制備
和乙醇制備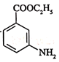 的合成路線(無機試劑任選)。________
的合成路線(無機試劑任選)。________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表中對應關系正確的是( )
A | CH3CH3+Cl2 CH2=CH2+HCl→CH3CH2Cl | 均為取代反應 |
B | 由油脂得到甘油;由鹵代烴制醇 | 均發生了水解反應 |
C | Cl2+2Br→2Cl+Br2;Zn+Cu2+→Zn2++Cu | 均為單質被還原的置換反應 |
D | 2Na2O2+2H2O→4NaOH+O2↑; 2F2+2H2O→4HF+ O2 | 均為水作還原劑的氧化還原反應 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com