
【題目】二氧化鈰(CeO2)是一種重要的稀土氧化物。以氟碳鈰礦(主要含CeFCO3)為原料制備CeO2的一種工藝流程圖如圖:
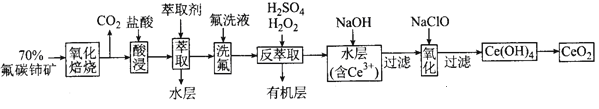
已知:①Ce4+既能與F-結合成[CeFX](4-x)+,也能與SO42-結合成[CeSO4]2+;
②在硫酸體系中Ce4+能被萃取劑[(HA)2]萃取,而Ce3+不能。
回答下列問題:
(1)“氧化焙燒”前需將礦石粉碎成細顆粒,其目的是_____。
(2)“酸浸”中會產生大量黃綠色氣體,寫出CeO2與鹽酸反應的離子方程式_____,為避免上述污染,請提出一種解決方案:_____。
(3)“萃取”時存在反應:Ce4++n(HA)2![]() Ce·(H2n-4A2n)+4H+。實驗室中萃取時用到的主要玻璃儀器名稱為_____。
Ce·(H2n-4A2n)+4H+。實驗室中萃取時用到的主要玻璃儀器名稱為_____。
(4)“反萃取”中,在稀硫酸和H2O2的作用下CeO2轉化為Ce3+,H2O2在該反應中作_____(填“催化劑”、“氧化劑”或“還原劑”),每有1molH2O2參加反應,轉移電子物質的量為_____。
(5)“氧化”步驟的化學方程式為_____。
(6)取上述流程得到的CeO2產品0.50g,加硫酸溶解后,用0.10mol/L FeSO4標準溶液滴定至終點時(鈰被還原為Ce3+,其他雜質均不參加反應),消耗25.00mL標準溶液。該產品中CeO2的質量分數為_____(Ce的相對原子質量為140)。
【答案】增大固體與空氣的接觸面積,增大反應速率,提高原料利用率2CeO2+2Cl-+8H+=2Ce3++Cl2↑+4H2O將HCl(鹽酸)改用H2SO4酸浸分液漏斗還原劑2mol2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl86%
【解析】
氟碳鈰礦(主要含CeFCO3),“氧化焙燒”的目的是將+3價鈰氧化成+4價,Ce4+能與F-結合成[CeFx](4-x)+,以便后續的提取,加稀硫酸,與硫酸根結合成[CeSO4]2+,加萃取劑,氟洗液,硫酸體系中Ce4+能被萃取劑[(HA)2]萃取,而Ce3+不能,加“反萃取”、加H2O2,又將Ce4+還原為Ce3+,發生反應2Ce4++H2O2=2Ce3++O2↑+2H+,加入堿后Ce3+轉化為沉淀,加入次氯酸鈉將Ce從+3氧化為+4,得到產品,據此解答。
(1)“氧化焙燒”前需將礦石粉碎成細顆粒,其目的是增大固體與空氣的接觸面積,增大反應速率,提高原料利用率;
(2)“酸浸”中會產生大量黃綠色氣體應為氯氣,CeO2與鹽酸發生氧化還原反應生成Ce3+和氯氣,反應的離子方程式為2CeO2+2Cl-+8H+=2Ce3++Cl2↑+4H2O,可以用硫酸代替鹽酸而避免產生氯氣污染;
(3)實驗室中萃取時用到的主要玻璃儀器名稱為分液漏斗;
(4)“反萃取”加H2O2的作用是將Ce4+離子重新還原為Ce3+,反應的離子方程式為2Ce4++H2O2=2Ce3++O2↑+2H+,H2O2在該反應中作還原劑,每有1mol H2O2參加反應,轉移電子的物質的量為2mol;
(5)“氧化”步驟中用次氯酸鈉將Ce3+氧化成Ce4+,反應的離子方程式為2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl;
(6)FeSO4的物質的量為0.1000molL-1×0.025L=0.0025mol,根據電子得失守恒可得關系式CeO2~FeSO4,所以CeO2的質量為0.0025×172g=0.4300g,產品中CeO2的質量分數為
0.4300g/0.500g×100%=86%。


科目:高中化學 來源: 題型:
【題目】下列關于苯的敘述正確的是( )
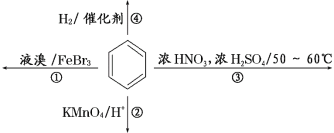
A. 反應①常溫下不能進行
B. 反應②不發生,但是仍有分層現象,紫色層在上層
C. 反應③為取代反應,加熱方式為酒精燈直接加熱
D. 反應④能發生,生成的產物其二氯代物有4種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,可逆反應A(g)+3B(g)![]() 2C(g)達到平衡的標志是( )
2C(g)達到平衡的標志是( )
A. 單位時間內消耗1molA的同時生成2molC
B. 單位時間內消耗nmolA的同時生成2nmolB
C. A、B、C的物質的量之比為1:2:3
D. A、B、C的濃度不再發生變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮及其化合物與人類生產、生活息息相關。回答下列問題:
(1)基態氮原子的價電子排布圖是______________。
(2)B、N、O三種元素第一電離能從大到小的順序是__________。
(3)NaNO2中氮原子的雜化方式是____________,陰離子的立體構型是__________。
(4)NF3的鍵角____________NH3的鍵角(填“<”“>”或“=”),原因是____________。
(5)NH4BF4(氟硼酸銨)是合成氮化硼納米管的原料之一。1 mol NH4BF4含有_______mol配位鍵。
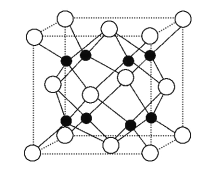
(6)安全氣囊的設計原理為6NaN3+Fe2O3![]() 3Na2O+2Fe+9N2↑。
3Na2O+2Fe+9N2↑。
①該反應中元素的電負性由大到小的順序是____________;
②Na2O的晶胞結構如圖所示,晶胞邊長為566 pm,晶胞中氧離子的配位數為____________,Na2O晶體的密度為________g·cm-3(只要求列算式,不必計算出結果)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式表示正確的是 ( )
A. 往FeI2溶液中通入過量氯氣:Cl2+2Fe2+===2Cl-+2Fe3+
B. 將明礬溶于水中生成膠體:Al3++3H2O![]() Al(OH)3(膠體)+3H+
Al(OH)3(膠體)+3H+
C. 大理石溶于醋酸中:CaCO3+2H+===Ca2++H2O+CO2↑
D. 銅與稀硝酸反應:3Cu+4H++2NO3-===3Cu2++2NO↑+2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以下是依據一定的分類標準,對某些物質與水反應情況進行分類的圖示。
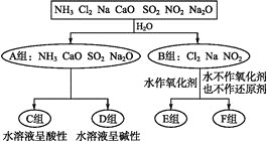
請根據你所學的知識,按要求填空:
(1)上述第一級分類標準(分成A,B組的依據)是____。
(2)F組中物質除了Cl2外還有____(填化學式)。
(3)A組中的CaO經常用作食品包裝袋中的干燥劑,CaO所屬的物質類型為____(用序號填空)。
①金屬氧化物 ②堿性氧化物 ③堿 ④堿性干燥劑
CaO可作干燥劑的理由是____________(用化學方程式表示)。
(4)D組中NH3的水溶液呈弱堿性,用電離方程式表示其呈弱堿性的原因:________。
(5)由Al3+制備Al(OH)3,最好不選擇D組中的NaOH溶液,說明理由:___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有一混合物的水溶液,可能含有以下離子中的幾種:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 現取三份各100mL溶液進行如下實驗: 第一份加入
現取三份各100mL溶液進行如下實驗: 第一份加入![]() 溶液有沉淀產生;第二份加足量NaOH溶液加熱后,收集到
溶液有沉淀產生;第二份加足量NaOH溶液加熱后,收集到![]() 氣體;第三份加足量
氣體;第三份加足量![]() 溶液后,得到干燥沉淀
溶液后,得到干燥沉淀![]() ,經足量鹽酸洗滌、干燥后,沉淀質量為
,經足量鹽酸洗滌、干燥后,沉淀質量為![]() 。你認為以下結論正確的是
。你認為以下結論正確的是
A. 該混合液中一定含有:![]() 、
、![]() 、
、![]() 、
、![]() ,可能含
,可能含![]() ,且
,且![]()
B. 該混合液中一定含有:![]() 、
、![]() 、
、![]() ,可能含
,可能含![]() 、
、![]()
C. 該混合液中一定含有:![]() 、
、![]() 、
、![]() ,可能含
,可能含![]() 、
、![]() 、
、![]()
D. 該混合液中一定含有:![]() 、
、![]() ,可能含
,可能含![]() 、
、![]() 、Cl-
、Cl-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用甲烷與氯氣發生取代反應制取副產品鹽酸的設想已成為現實。某化學興趣小組在實驗室中模擬上述過程(反應緩慢不發生爆炸),其設計的模擬裝置如下:
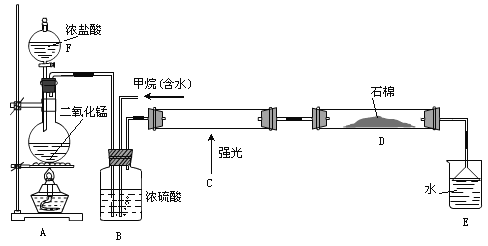
根據要求填空:
(1)儀器F的名稱______________;A中反應的離子反應方程式___________________。
(2)B裝置有三種功能:①控制氣流速度;②均勻混合氣體③______________________。
(3)為了除多余的氯氣,D裝置中的石棉網均勻附著KI粉末,你認為能否換成堿石灰______(填“能”或“不能”)。
(4)E裝置的作用________。
A.收集氣體 B.吸收氯氣 C.防止倒吸 D.吸收氯化氫
(5)E裝置中除了鹽酸生成外,還含有有機物,從E中分離出鹽酸的最佳方法:_____________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com