
【題目】下列溶液中微粒的物質的量濃度關系正確的是
A. 25℃時,向0.1mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
B. 25℃時,NaB溶液的pH=8,c(Na+)- c(B-)=9.9×10-7 mol·L-1
C. 0.1 mol·L-1NaHCO3溶液:c(Na+)>c(oH-)>c(HCO3-)>c(H+)
D. 相同物質的量濃度的CH3COONa和NaClO的混合液中,各離子濃度的大小關系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
【答案】B
【解析】
A.25℃時,向0.1mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性時若c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)則違背溶液呈電中性原理,應該為c(Na+)>c(SO42—)>c(NH4+)>c(OH—)=c(H+),選項A錯誤。B. 在溶液中存在水解平衡:B-+H2O![]() HB+OH-,pH=8,c(H+)=10-8mol/L,c(OH-)=10-6mol/L根據電荷守恒有c(Na+) + c(H+)=c(B-)+ c(OH-),則c(Na+) -c(B-)=c(OH-)-c(H+)=9.9×10-7mol/L,選項B正確;C、0.1 mol/LNaHCO3溶液中,碳酸氫根離子水解顯堿性,則c(Na+)>c(HCO3-)>c(OH-)>c(H+),選項C錯誤;D、醋酸的電離常數大于次氯酸,所以醋酸的水解程度小于次氯酸,醋酸鈉和次氯酸鈉都是強堿弱酸鹽,其混合溶液呈堿性,所以相同物質的量濃度的CH3COONa和NaClO的混合液中,各離子濃度的大小關系是:c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),選項D錯誤。答案選B。
HB+OH-,pH=8,c(H+)=10-8mol/L,c(OH-)=10-6mol/L根據電荷守恒有c(Na+) + c(H+)=c(B-)+ c(OH-),則c(Na+) -c(B-)=c(OH-)-c(H+)=9.9×10-7mol/L,選項B正確;C、0.1 mol/LNaHCO3溶液中,碳酸氫根離子水解顯堿性,則c(Na+)>c(HCO3-)>c(OH-)>c(H+),選項C錯誤;D、醋酸的電離常數大于次氯酸,所以醋酸的水解程度小于次氯酸,醋酸鈉和次氯酸鈉都是強堿弱酸鹽,其混合溶液呈堿性,所以相同物質的量濃度的CH3COONa和NaClO的混合液中,各離子濃度的大小關系是:c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),選項D錯誤。答案選B。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】下列分離物質的方法正確的是( )
A.用萃取的方法除去花生油中的水分
B.用過濾的方法除去NaCl溶液中含有的少量KNO3
C.用酒精萃取碘水中的碘
D.用蒸餾的方法除去水中的不揮發性雜質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以下有關焊錫(錫和鉛)的結論正確的是( )
A.焊錫的熔點比錫和鉛的熔點低
B.焊錫的熔點比錫和鎘的熔點低
C.焊錫的熔點比錫和鉍熔點低
D.焊錫的熔點比鉛、錫的熔點都高
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙烯催化氧化成乙醛可設計成如下圖所示的燃料電池,能在制備乙醛的同時獲得電能,其總反應為:2CH2=CH2+ O2→2CH3CHO。下列有關說法正確的是
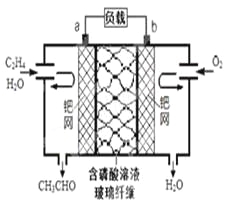
A. 該電池為可充電電池
B. 每有0.1mol O2反應,則遷移H+ 0.4mol
C. 正極反應式為:CH2=CH2-2e-+ 2OH-→CH3CHO + H2O
D. 電子移動方向:電極a→磷酸溶液→電極b
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】霧霾嚴重影響人們的生活與健康,某地區的霧霾中可能含有如下離子中的若干種:NH4+、Ba2+、Fe2+、Cl-、NO3-、CO32- 、SO42-.某同學收集了該地區的霧霾,經必要的預處理后得到試樣溶液,設計并完成如下實驗:

試回答下列問題:
(1)實驗①中加入稀鹽酸后,有無色氣體A生成,溶液B依然澄清,且溶液中陰離子種類不變,據此可知原溶液中一定不含__________。(填離子符號)
(2)實驗①中發生反應的離子方程式為__________________________________________。
(3)實驗②中逐滴加入碳酸氫鈉溶液,立即有氣泡產生,一段時間后又有沉淀出現,這時的離子方程式為_______________________________________________ 。
(4)氣體F的成分為______________。(填化學式)
(5)根據實驗③現象該同學認為原溶液中一定含有SO42-,有其他同學認為其結論不合理,又進行了后續實驗 ④,最終確認原溶液中含有SO42-,試寫出實驗④可行的操作方法及現象________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】ClO2 是一種高效安全的殺菌消毒劑。用氯化鈉電解法生成ClO2的工藝原理示意圖如下圖, 發生器內電解生成ClO2。下列說法正確的是

A. a氣體是氯氣,b氣體是氫氣
B. 氯化鈉電解槽內每生成2 mol a氣體,轉移2mol e-
C. ClO2發生器中陰極的電極反應式為:ClO3- + 2H+ + e-![]() ClO2↑ + H2O
ClO2↑ + H2O
D. 為使a、b氣體恰好完全反應,理論上每生產1molClO2需要補充44.8Lb氣體(標況下)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)一定溫度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向濃度均為0.20mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成________沉淀(填化學式);當測得溶液其中一種金屬陽離子沉淀完全(濃度小于10-5mol·L-1)時,溶液中的另一種金屬陽離子的物質的量濃度為________。
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等雜質),實驗室利用毒重石制備BaCl2·2H2O的流程如下:

①毒重石用鹽酸浸取前需充分研磨,目的是________。
②加入NH3·H2O調節pH=8可除去________(填離子符號),濾渣Ⅱ中含________(填化學式)。加入H2C2O4時應避免過量,原因是________。
Ca2+ | Mg2+ | Fe3+ | |
開始沉淀時的pH | 11.9 | 9.1 | 1.9 |
完全沉淀時的pH | 13.9 | 11.1 | 3.7 |
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
(3)已知25℃時,CaSO4在水中的沉淀溶解平衡曲線如圖所示,向100mL該條件下的CaSO4飽和溶液中加入400mL 0.01mol·L-1 Na2SO4溶液,下列敘述正確的是___(填字母)。

A.溶液中析出CaSO4沉淀,最終溶液中c(SO42-)比原來的大
B.溶液中無沉淀析出,溶液中c(Ca2+)、c(SO42-)都變小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都變小
D.溶液中無沉淀析出,但最終溶液中c(SO42-)比原來的大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生做如下實驗:第一步,在淀粉KI溶液中,滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即變藍;第二步,在上述藍色溶液中,滴加足量的Na2SO3溶液,藍色逐漸消失。下列有關該同學對實驗原理的解釋和所得結論的敘述不正確的是( )
A. 氧化性:ClO->I2>SO42—
B. 藍色消失的原因是Na2SO3溶液具有漂白性
C. 淀粉KI溶液變藍是因為I-被ClO-氧化為I2,I2使淀粉變藍
D. 若將Na2SO3溶液加入氯水中,氯水褪色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下面的排序不正確的是
A. 酸性由大到小:HPO3>H3PO4>H3PO3 B. 硬度由大到小:金剛石>碳化硅>晶體硅
C. 熔點由高到低:Na>Mg>Al D. 晶格能由大到小:NaF>NaCl>NaBr>NaI
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com