
【題目】強酸制弱酸非常重要的一種離子反應,已知:
Ka1 | Ka2 | |
H2SO3 |
|
|
H2CO3 |
|
|
下列離子反應不正確的有( )個
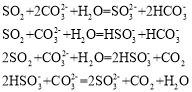
A.0個B.1個C.2個D.3個
【答案】B
【解析】
根據K大小得出酸強弱順序為H2SO3 > H2CO3> HSO3- > HCO3-。由于H2SO3 >H2CO3> HSO3-,因此SO2 + CO32 + H2O = HSO3- + HCO3-,由于H2CO3 >HSO3- > HCO3-,因此HSO3- + CO32 = SO32 + HCO3-,兩個方程式相加得到SO2 +2CO32 + H2O = SO32 + 2HCO3-,故第一個、第二個正確;由于H2CO3> HSO3-,因此SO2 + CO32 + H2O = HSO3- + HCO3-,由于H2SO3 > H2CO3,因此SO2 + HCO3- = HSO3- + CO2,兩個方程式相加2SO2 + CO32 + H2O = 2HSO3- + CO2,故第三個正確;2HSO3- + CO32 = CO2+ H2O + 2SO32違背了H2CO3> HSO3-,故第四個錯誤,故B正確。
綜上所述,答案為B。


科目:高中化學 來源: 題型:
【題目】常溫下,向1L0.1 molL—l 一元酸HR溶液中逐漸通入氨氣[已知常溫下NH3 H2O電離平衡常數K = l .76x 10-5], 使溶液溫度和體積保持不變, 混合溶液的pH與離子濃度變化的關系如圖所示。下列敘述正確的是
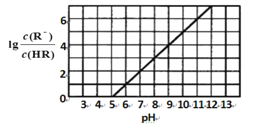
A.0. l molL—1HR 溶液的pH為5
B.HR為弱酸,常溫時隨著氨氣的通入,c(R—)/[c(OH—).c(HR)] 逐漸增大
C.當通入0.1 mol NH3時,c(NH4+ > c(R—)
D.當c(R— )=c(HR)時 溶液必為中性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子反應方程式正確的是( )
A.Fe(OH)3溶于稀 H2SO4 中:H++OH﹣→H2O
B.氨水滴入AlCl3溶液中:Al3++3OH﹣→Al(OH)3↓
C.FeO溶于稀HCl中:O2﹣+2H+→H2O
D.鋁溶解在NaOH溶液中:2Al+2OH﹣+2H2O→2AlO2﹣+3H2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室利用反應TiO2(s)+CCl4(g) ![]() TiCl4(g)+CO2(g),在無水無氧條件下制取TiCl4,實驗裝置如圖所示(CCl4、TiCl4的沸點分別為76 ℃、136 ℃,CCl4與TiCl4互溶)。下列說法正確的是
TiCl4(g)+CO2(g),在無水無氧條件下制取TiCl4,實驗裝置如圖所示(CCl4、TiCl4的沸點分別為76 ℃、136 ℃,CCl4與TiCl4互溶)。下列說法正確的是
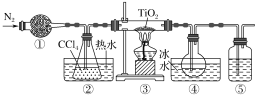
A.①、⑤分別盛裝堿石灰、NaOH溶液
B.②中熱水的作用是使CCl4汽化,④中冰水的作用是使TiCl4冷凝
C.③中反應結束后,先停止通N2,再停止加熱
D.分離④中的液態混合物,采用的操作是分液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溫度為T時,向2.0L恒容密閉容器中充入1.0mol PCl5,反應PCl5(g)PCl3(g)+Cl2(g),經過一段時間后達到平衡。反應過程中測定的部分數據見下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列說法正確的是( )
A.反應在50s時的速率v(PCl3)=0.0016molL﹣1s﹣1
B.保持其他條件不變,升高溫度,平衡時c(PCl3)=0.11molL﹣1,則反應的△H<0
C.相同溫度下,起始時向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,反應達到平衡前v(正)>v(逆)
D.相同溫度下,起始時向容器中充入2.0molPCl3和2.0molCl2,達到平衡時,PCl3的轉化率小于80%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成具有良好生物降解性的有機高分子材料是有機化學研究的重要課題之一。聚醋酸乙烯酯(PVAc)水解生成的聚乙烯醇(PVA),具有良好生物降解性,常用于生產安全玻璃夾層材料PVB。有關合成路線如圖(部份反應條件和產物略去)。
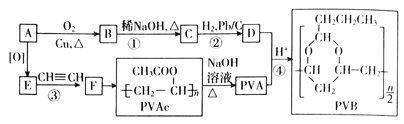
已知:I.A為飽和一元醇,其中氧的質量分數約為34.8%;
II.![]()
![]() ;
;
III.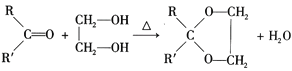 (R、R’可表示烴基或氫原子)
(R、R’可表示烴基或氫原子)
請回答:
(1)C中官能團的名稱為_____________,寫出C的反式異構體的結構簡式:_______________,該分子中最多有______________個原子共面
(2)D與苯甲醛反應的化學方程式為_________________________________________________。
(3)③的反應類型是_________________________
(4)寫出兩種與F具有相同官能團的同分異構體的結構簡式_____________________________。
(5)參照上述信息,設計合成路線,以溴乙烷為原料(其他無機試劑任選)合成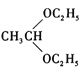 ,_____________
,_____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋰—空氣電池充放電基本原理如圖所示,電池裝置中間用高分子隔膜隔開,下列說法不正確的是( )
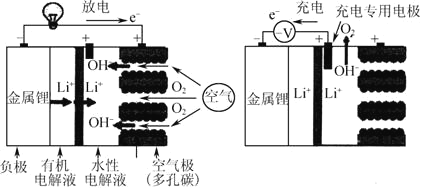
A.充電時,鋰離子向陰極移動
B.充電時陰極電極反應式為Li++e- = Li
C.放電時正極電極反應式為O2+4e-+2H2O = 4OH-
D.電池裝置中高分子隔膜允許水分子自由移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】傳統的定量化學實驗受到計量手段的制約而研究范圍狹窄、精確度不高,DIS數字化信息系統(由傳感器、數據采集器和計算機組成)因為可以準確測量溶液的pH等而在中和滴定的研究中應用越來越廣泛深入。

(1)田老師利用DIS系統探究強堿和不同酸的中和反應,實驗過程如下:
Ⅰ.分別配制0.1000mol/L的NaOH、HCl、CH3COOH溶液備用。
Ⅱ.用0.1000mol/L的NaOH溶液分別滴定10.00mL0.1000mol/L的HCl和CH3COOH溶液,連接數據采集器和pH傳感器。
Ⅲ.由計算機繪制的滴定曲線如圖一:
①A是_____;
②兩曲線圖中V1_____V2 (填“>”、“=”或“<”),A點和B點,水的電離程度相比_________(填“A大”、“B大”、“一樣大”或“無法判斷”)。
(2)程老師利用DIS系統測定某醋酸溶液的物質的量濃度,以測量溶液導電能力來判斷滴定終點,實驗步驟如下:用_____(填儀器名稱)量取20.00mL醋酸溶液樣品,倒入潔凈干燥錐形瓶中,連接好DIS系統,如果錐形瓶中含有少量蒸餾水,是否會影響測量結果_____(填“是”、“否”或“不能確定”),向錐形瓶中滴加0.1000mol/L的NaOH溶液,計算機屏幕上顯示出溶液導電能力與加入NaOH溶液體積關系的曲線圖(見圖二)。
①圖中b點時,![]() _______mol/L
_______mol/L
②若圖中某一點pH等于8,則c(Na+)﹣c(CH3COO﹣)的精確值為_____ mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水楊酸是合成阿斯匹林的重要原料。水楊酸的結構簡式為![]()
請回答下列問題:
(1)請寫出水楊酸中除苯環外具有的官能團的名稱______________________;
(2)請寫出與水楊酸互為同分異構體,既屬于酚類又屬于酯類化合物的結構簡式:____________________________________________________;
(3)寫出水楊酸與碳酸氫鈉反應的化學方程式:______________________
(4)在一定條件下,水楊酸與乙酸酐可合成阿斯匹林,阿斯匹林如下圖所示,1摩爾阿司匹林與氫氧化鈉完全反應需要氫氧化鈉_____摩爾。
![]()
(5)阿斯匹林藥片需要保存在干燥處,受潮的藥片易變質不宜服用;檢驗受潮藥片是否變質的試劑是(只選一種試劑即可)_________________________________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com