
【題目】以下實驗操作及現象均正確的是![]()
A. 實驗Ⅰ:產生紅褐色沉淀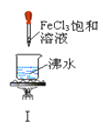
B. 實驗Ⅱ:溶液顏色變紅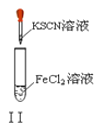
C. 實驗Ⅲ:放出大量氣體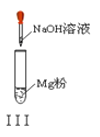
D. 實驗Ⅳ:先出現白色沉淀,后溶解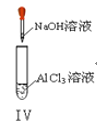
科目:高中化學 來源: 題型:
【題目】在3個體積均為1 L的恒容密閉容器中發生反應:SO2(g)+2NO(g)![]() 2NO2(g)+S(s)。改變容器I的反應溫度,平衡時c( NO2)與溫度的關系如下圖所示。下列說法正確的是
2NO2(g)+S(s)。改變容器I的反應溫度,平衡時c( NO2)與溫度的關系如下圖所示。下列說法正確的是
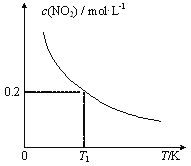
A. 若T2<T1,達到平衡時,容器Ⅲ中NO的體積分數小于40%
B. 該反應的ΔH>0
C. T1時,該反應的平衡常數為![]()
D. 容器Ⅰ與容器Ⅱ均在T1時達到平衡,總壓強之比小于1:2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關物質性質或應用的說法正確的是( )
A.晶體硅是半導體,故在通信工程中用于制光導纖維
B.氧化鎂的熔點高,可作優質的耐高溫材料
C.液氨汽化放出大量的熱,可用作制冷劑
D.明礬具有強氧化性,常用于自來水的殺菌消毒
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】生產中可用雙氧水氧化法處理電鍍含氰廢水,某化學興趣小組模擬該法探究有關因素對破氰反應速率的影響(注:破氰反應是指氧化劑將CN-氧化的反應)。
【相關資料】
①氰化物主要是以CN-和[Fe(CN)6]3-兩種形式存在。
②Cu2+可作為雙氧水氧化法破氰處理過程中的催化劑;Cu2+在偏堿性條件下對雙氧水分解影響較弱,可以忽略不計。
③[Fe(CN)6]3-較CN-難被雙氧水氧化,且pH越大,[Fe(CN)6]3-越穩定,越難被氧化。
【實驗過程】
在常溫下,控制含氰廢水樣品中總氰的初始濃度和催化劑Cu2+的濃度相同,調節含氰廢水樣品不同的初始pH和一定濃度雙氧水溶液的用量,設計如下對比實驗:
(1)請完成以下實驗設計表(表中不要留空格)。
實驗序號 | 實驗目的 | 初始pH | 廢水樣品體積/mL | CuSO4溶液的體積/mL | 雙氧水溶液的體積/mL | 蒸餾水的體積/mL |
① | 為以下實驗操作參考 | 7 | 60 | 10 | 10 | 20 |
② | 廢水的初始pH對破氰反應速率的影響 | 12 | 60 | 10 | 10 | 20 |
③ | ________ | 7 | 60 | ______ | ______ | 10 |
實驗測得含氰廢水中的總氰濃度(以CN-表示)隨時間變化關系如圖所示。
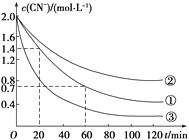
(2)實驗①中20~60 min時間段反應速率:v(CN-)=______mol·L-1·min-1。
(3)實驗①和實驗②結果表明,含氰廢水的初始pH增大,破氰反應速率減小,其原因可能是____________________(填一點即可)。在偏堿性條件下,含氰廢水中的CN-最終被雙氧水氧化為HCO,同時放出NH3,試寫出該反應的離子方程式:____________。
(4)該興趣小組同學要探究Cu2+是否對雙氧水氧化法破氰反應起催化作用,請你幫助他們設計實驗并驗證上述結論,完成下表中內容(已知:廢水中的CN-濃度可用離子色譜儀測定) ______。
實驗步驟(不要寫出具體操作過程) | 預期實驗現象和結論 |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液中可能含有如下離子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。當向該溶液中逐滴加入NaOH溶液時,產生沉淀的物質的量(n)與加入NaOH溶液的體積(V)的關系如圖所示,下列說法正確的是( )

A. 原溶液中一定含有的陽離子是H+、Mg2+、Al3+、NH4+
B. 反應最后形成的溶液中的溶質含AlCl3
C. 原溶液中Al3+與NH的物質的量之比為1∶3
D. 原溶液中含有的陰離子是Cl-、AlO2-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇是一種可再生能源,由CO2制備甲醇的過程可能涉及的反應如下:
反應Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
反應Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反應Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77 kJmol-1
CH3OH(g) △H3=-90.77 kJmol-1
回答下列問題:
(1)甲醇熔融碳酸鹽電池是一種新型燃料電池,該電池以熔融的Na2CO3為電解質,寫出該電池負極的電極反應式:_____________________________
(2)恒容條件下,能表明反應I達到化學平衡狀態的是________。
a.混合氣體的密度不變 b.反應容器中甲醇的百分含量不變
c.反應物的反應速率與生成物的反應速率之比等于化學計量數之比
d.混合氣體的壓強不變
(3)反應Ⅱ的△H2=__________。
(4)在一定條件下2 L恒容密閉容器中充入3 mol H2和1.5 mol CO2,僅發生反應Ⅰ,溫度為500℃時,該反應10 min時達到平衡,CO2的平衡轉化率為60℅,用H2表示該反應的速率為____________。
(5)某研究小組將一定量的H2和CO2充入恒容密閉容器中并加入合適的催化劑(發生反應I、Ⅱ、Ⅲ),測得不同溫度下體系達到平衡時CO2的轉化率(a)及CH3OH的產率(b),如圖所示。
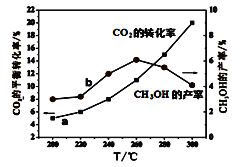
據圖可知當溫度高于260℃后,CO的濃度隨著溫度的升高而_________(填“增大”、“減小”、“不變”或“無法判斷”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】請回答以下有關細胞物質組成和功能的問題:
(1)水是活細胞和生物體中含量最多的化合物,人體中水的含量約占65%,下列選項中能正確說明水對人體重要性的是______________________。
①水和糖類、脂肪、蛋白質一樣,能為人體提供能量
②沒有水人體內大部分化學反應就根本不會發生
③水的比熱小,有利于維持體溫
④體內營養物質的運輸離不開水
⑤水在人體組織器官中也可以結合水的形式存在
(2)糖類不僅是生物體生命活動的主要能源物質,還有許多重要作用,如下圖:
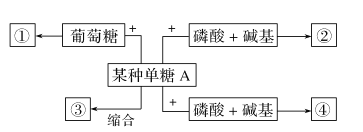
如果某種單糖A與葡萄糖縮合失去1分子水后形成的物質①遇斐林試劑不產生磚紅色沉淀,則某種單糖A是________________。
如果某種單糖A縮合反應形成的物質③作為植物細胞壁的主要組成成分,則物質③是____________;如果某種單糖A與磷酸和堿基結合形成物質②,其中堿基是尿嘧啶,則形成的物質②是__________________;這說明糖類是___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關實驗裝置進行的相應實驗,能達到實驗目的的是( )
A. 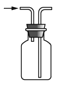 收集 NOB.
收集 NOB.  制備 NH3
制備 NH3
C. 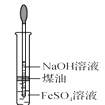 制備 Fe(OH)2D.
制備 Fe(OH)2D.  稀釋濃 H2SO4
稀釋濃 H2SO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質轉化在給定條件下能實現的是
①Al2O3![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3
Al(OH)3
②S![]() SO3
SO3![]() H2SO4
H2SO4
③飽和NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
④Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 無水FeCl3
無水FeCl3
⑤MgCl2(aq)![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO
A. ①③⑤ B. ②③④ C. ②④⑤ D. ①④⑤
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com