
【題目】某校化學興趣小組的同學對含有少量Na2SO4的NaOH樣品中NaOH的含量進行測定。回答下列問題:
(1)甲同學運用沉淀法測定樣品中NaOH的含量。該同學選用的藥品有樣品、蒸餾水、MgCl2溶液,需要測定的實驗數據有__________。
(2)乙同學運用中和滴定法測定樣品中NaOH的含量。
①用分析天平準確稱取該樣品5.0000 g,全部溶于水配制成1000.0 mL溶液。用堿式滴定管量取20.00 mL所配溶液放在錐形瓶中,滴加幾滴指示劑,待測。滴定管在使用前除洗滌外,還應____________________________________。
②用濃度為0.100 0 mol·L-1的鹽酸標準溶液進行滴定。開始滴定前的一步操作是________。
③滴定過程中用pH計測定錐形瓶中溶液的pH,臨近滴定終點時測定pH應每滴一滴測一次。
④滴定過程中,錐形瓶中溶液的pH變化如下:
V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
請在坐標圖中繪制出上述中和滴定的曲線。______________

⑤如表所示是幾種酸堿指示劑的變色范圍,根據你所作的中和滴定曲線分析,上述中和滴定中應選用的指示劑是________。
指示劑 | 變色范圍(pH) | 顏色 | |
酸 | 堿 | ||
甲基橙 | 3.1~4.4 | 紅 | 黃 |
石蕊 | 5.0~8.0 | 紅 | 藍 |
酚酞 | 8.2~10.0 | 無 | 紅 |
⑥樣品中,NaOH的質量百分含量為____________。
【答案】 樣品質量和加入足量MgCl2溶液后生成的沉淀質量 檢漏、潤洗 調節盛標準液的滴定管的液面于“0”刻度或“0”刻度以下 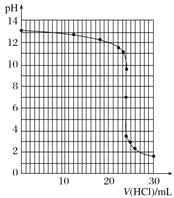 甲基橙或酚酞 96%
甲基橙或酚酞 96%
【解析】(1)甲同學運用沉淀法測定樣品中NaOH的含量。根據該同學選用的藥品,可以判斷其實驗原理是:稱量一定量的樣品,然后溶于水配成溶液,加入足量的MgCl2溶液,測量所生成的沉淀的質量。所以,需要測定的實驗數據有:樣品質量和加入足量MgCl2溶液后生成的沉淀質量。
(2)①用分析天平準確稱取該樣品5.0000 g,全部溶于水配制成1000.0 mL溶液。用堿式滴定管量取20.00 mL所配溶液放在錐形瓶中,滴加幾滴指示劑,待測。滴定管在使用前除洗滌外,還應檢漏、潤洗。
②用濃度為0.100 0 mol·L-1的鹽酸標準溶液進行滴定。開始滴定前的一步操作是調節盛標準液的滴定管的液面于“0”刻度或“0”刻度以下。
③滴定過程中用pH計測定錐形瓶中溶液的pH,臨近滴定終點時測定pH應每滴一滴測一次。
④根據滴定過程中錐形瓶中溶液的pH值,在坐標圖中繪制出上述中和滴定的曲線如下: 
⑤根據所作的中和滴定曲線分析,該中和滴定終點的pH=7,根據指示劑的變色范圍可知,上述中和滴定中可以選用的指示劑有甲基橙或酚酞。
⑥由題中數據可知,20.00 mL樣品溶液消耗了0.100 0 mol·L-1的鹽酸24.00mL,所以n(NaOH)=n(HCl)= ![]() 2.4
2.4![]() mol,NaOH的質量百分含量為
mol,NaOH的質量百分含量為 96% 。
96% 。


科目:高中化學 來源: 題型:
【題目】A、B、C均為中學化學常見的純凈物,它們之間存在如下轉化關系:
![]()
其中①②③均為有單質參與的反應。
(1)若A是常見的金屬,①③中均有同一種氣態非金屬單質參與反應,B溶液遇KSCN顯血紅色,且②為化合反應,寫出反應②的離子方程式_______________________________。
(2)如何檢驗上述C溶液中的陽離子?______________________。
(3)若B是太陽能電池用的光伏材料,①②③為工業制備B的反應。C的化學式是____________,寫出反應①的化學方程式____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】煤的主要組成元素是碳、氫、氧、硫、氮,還有極少量的磷、砷、鍺、鎵、銦等元素, 燃煤產生CxHy、SO2、NOX等大氣污染物,研究NO2、NO、CO、SO2等大氣污染物和水污染物的處理對建設美麗中國具有重要意義。
(1)鍺是第四周期第ⅣA元素,其原子結構示意圖為_______________。
(2)利用煤的氣化獲得的水煤氣(主要成分為CO、CO2和H2)在催化劑作用下可以合成綠色燃料甲醇。
已知:H2O(l)=H2O(g) △H1=+44.0kJ/mol
CO2(g)+H2(g)=CO(g)+H2O(l) △H2=-3.0 kJ/mol
CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H3=-58.7 kJ/mol
寫出由CO與H2制備CH3OH氣體的熱化學方程式_________________。
(3)甲醇和CO2可直接合成碳酸二甲酯(CH3OCOOCH3,簡稱DMC):
2CH3OH(g)+CO2(g)![]() CH3OCOOCH3(g)+H2O(g) △H4<0
CH3OCOOCH3(g)+H2O(g) △H4<0
①該化學反應的平衡常數表達式為K=________________。
②在恒溫恒容密閉容器中發生上述反應,能說明反應達到平衡狀態的是_______(填標號)。
A.v正(CH3OH)= 2v逆(H2O) B.容器內氣體的密度不變
C.容器內壓強不變 D.CH3OH與CO2的物質的量之比保持不變
③一定條件下分別向甲、乙、丙三個恒容密閉容器中加入一定量的初始物質發生該反應,各容器中溫度、反應物的起始量如下表,反應過程中DMC的物質的量濃度隨時間變化如下圖所示:


甲容器中,在5-15min中的平均反應速率v(CO2) =__________。乙容器中,若平衡時n(CO2) =0.2mol,則T1__________T2(填“>”“<"或”=”)。甲、丙兩容器的反應達平衡時CO2的轉化率:甲__________丙(填“>”“<"或”=”)。
(4)直接排放含SO2的煙氣會形成酸雨,危害環境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反應后的溶液中,它們的物質的量分數X(ⅰ)與溶液pH的關系如圖所示。

①若是0.1mol/LNaOH 反應后的溶液,測得溶液的pH=8時,溶液中各離子濃度由大到小的順序是__________________。
②向pH=5的NaHSO3溶液中滴加一定濃度的CaCl2 溶液,溶液中出現渾濁,pH降為2,用化學平衡移動原理解釋溶液pH降低的原因_________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇、乙醇是生活中常見且用途廣泛的物質,其合成方法和性質均具有研究價值。
(1)已知下表中鍵能數據,則氣態乙醇完全燃燒生成CO2和水蒸氣的熱化學方程式為__________。
化學鍵 | C-C | C-H | O-O | H-O | C-O | C-O |
鍵能/(kJ·mol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
(2)向一容積可變的密閉容器中充入1mol CO與2 molH2,發生反應:CO(g)+2H2(g)![]() CH3OH(g) △H1<0。CO在不同溫度下的平衡轉化率(a)與壓強的關系如圖所示。
CH3OH(g) △H1<0。CO在不同溫度下的平衡轉化率(a)與壓強的關系如圖所示。
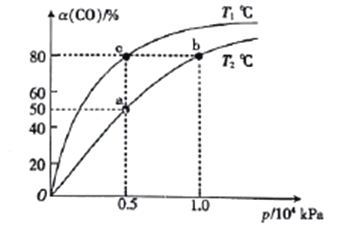
①a、b兩點的反位速率:v(b)_____v(a)(填“>”“<”或“=”,下同)。
②T1____T2。
③該合成反應的溫度一般控制在240~270℃,選擇此范圍的原因:此溫度范圍下的催化劑活性高;__________________________。
④圖中a、b、c三點對應的化學平衡常教K(a)、K(b)、K(c)的大小關系為_________。
(3)利用合成氣(主要成分為CO和H2)合成甲醇,主要發生如下反應:
CO(g)+2H2(g) ![]() CH3OH(g) △H1;
CH3OH(g) △H1;
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2;
CO(g)+H2O(g) △H2;
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3。
CH3OH(g)+H2O(g) △H3。
上述反應對應的平衡常數分別為K1、K2、K3,其中K1、K2隨溫度的變化如圖所示。

則△H1_____((填“>”“<”或“=”) △H3,理由是__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用電化學原理還原CO2制取ZnC2O4的裝置如圖所示(電解液不參加反應),下列說法正確的是

A. 可用H2SO4溶液作電解液
B. 陽離子交換膜的主要作用是増強導電性
C. Pb電極的電極反應式是2CO2-2e-==C2O42-
D. 工作電路中毎流過0.02mol電子,Zn電極質量減重0.65g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】月球含有H、He、N、Na、Mg、Si等元素,是人類未來的資源寶庫。
(1)3He是高效核能原料,其原子核內中子數為_____________。
(2)Na的原子結構示意圖為______。
(3)MgCl2在工業上應用廣泛,可由MgO制備。
①月球上某礦石經處理得到的MgO中含有少量SiO2,用NaOH溶液除去SiO2的化學方程式為______。
②MgO與炭粉和氯氣在一定條件下反應可制備MgCl2,尾氣中的氯氣可用足量冷的NaOH溶液完全吸收,則生成的鹽為_________、_________(寫化學式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上用鋁土礦(主要成分為Al2O3,含Fe2O3等雜質)為原料冶煉鋁的工藝流程如下:
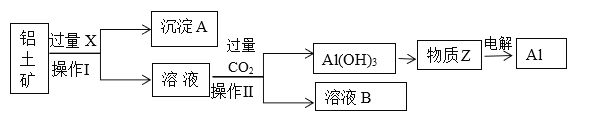
已知:2Al2O3![]() 4Al+3O2↑。
4Al+3O2↑。
(1)操作Ⅱ的名稱___________,用到的玻璃儀器有_______________。
(2)X是___________,操作Ⅱ通入過量CO2的離子方程式:______________________________________。
(3)沉淀A的主要成分是________,在生活中有什么應用:________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碘在自然界中有很多存在形式,在地殼中主要以NaIO3 形式存在,在海水中主要以I-形式存在,幾種粒子與Cl2之間有以下轉化關系:
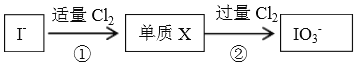
以下說法不正確的是
A. ①中發生的反應是:2I-+Cl2=I2+2Cl-
B. I-與過量Cl2發生的反應是:I-+3Cl2+3H2O=IO3-+6Cl-+6H+
C. 以上反應中,氯氣都體現氧化性,具體表現為:氯元素由0價降低為-1價
D. 通過以上信息,可預測:若在加入淀粉的KI溶液中逐滴滴加氯水,不能觀察到溶液變藍的現象
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】請根據下列有關規定的情景填空。
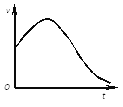
(1)①下圖是除去氧化膜的鎂條投入稀鹽酸中產生氫氣的速率隨時間的變化關系,曲線前段出現高峰的主要影響因素是________。
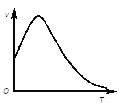
②下圖是過氧化氫在酶的催化作用下分解速率隨溫度的變化關系,曲線后段明顯下降的主要影響因素是__。
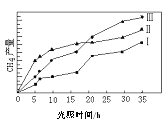
(2)利用光能和光催化劑,可將CO2和H2O(g)轉化為CH4和O2。紫外光照射時,在不同催化劑(I、II、III)作用下,CH4產量隨光照時間的變化見圖。在0~15小時內,CH4的平均生成速率I、II和III從大到小的順序為_________(填序號)。
(3)以TiO2/Cu2Al2O4為催化劑,可以將CO2和CH4直接轉化成乙酸。在不同溫度下催化劑的催化效率與乙酸的生成速率的關系見圖。
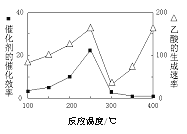
①250~300℃時,溫度升高而乙酸的生成速率降低的原因是_____________。
②當溫度的取值范圍在________時,溫度是影響乙酸的生成速率的主要因素。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com