
【題目】有機物F是合成多種藥物的重要中間體,一種合成路線如下:
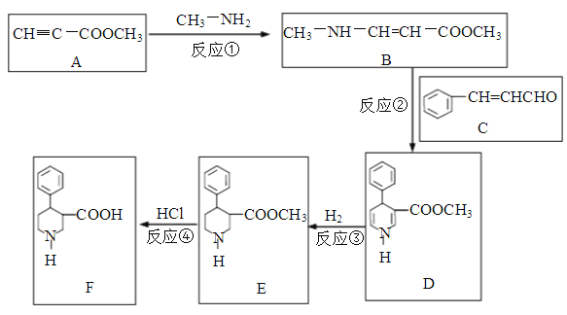
回答下列問題:
(1)寫出反應類型。反應①是__________反應,反應④是__________反應。
(2)化合物A中有________種官能團,寫出含氧官能團的結構式_____________。
(3)化合物C的俗名是肉桂醛,其分子式是____________。寫出肉桂醛跟新制Cu(OH)2在煮沸條件下發生反應的化學方程式______________________。
(4)由肉桂醛( ![]() )和乙酸制備
)和乙酸制備![]() 的合成路線如下:
的合成路線如下:
![]()
請將該合成路線補充完整(無機試劑任選)。________________
(合成路線常用的表示方式為:![]() )
)
【答案】加成 取代 2 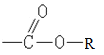 C9H80
C9H80 ![]() +2Cu(OH)2
+2Cu(OH)2![]()
![]() +Cu2O↓+2H2O
+Cu2O↓+2H2O 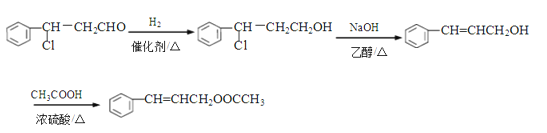
【解析】
比較反應物、生成物的結構,找出反應本質,判斷反應類型。設計合成反應途徑時,應考慮合理的反應途徑、并注意保護官能團等。
(1)比較A、B結構可知,反應①是CH3NH2中一個氨基H與A中C≡C發生加成反應生成B;比較E、F結構可知,反應④是E中酯基水解(取代反應)生成F。
(2)化合物A中有2種官能團:碳碳三鍵(-C≡C-)、酯基(-COOR),其中酯基含氧元素。
(3)化合物C(肉桂醛)的分子式是C9H80。它跟新制Cu(OH)2煮沸時醛基被氧化成羧基,反應的化學方程式![]() +2Cu(OH)2
+2Cu(OH)2![]()
![]() +Cu2O↓+2H2O。
+Cu2O↓+2H2O。
(4)合成反應第一步已有,為肉桂醛與HCl加成反應生成![]() 。目標產物
。目標產物![]() 可由
可由![]() 與乙酸(CH3COOH)酯化反應生成。故應補充由
與乙酸(CH3COOH)酯化反應生成。故應補充由![]() 合成
合成![]() 的路線,應先與H2加成使-CHO變成-CH2OH,再與強堿醇溶液共熱消去HCl。補充流程如下:
的路線,應先與H2加成使-CHO變成-CH2OH,再與強堿醇溶液共熱消去HCl。補充流程如下:


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】工業上用軟錳礦(只含MnO2和MnO)、H2SO4(過量)和FeS2制備MnSO4·H2O的流程如下(已知流程中的FeS2、FeSO4、MnO2、MnO均完全反應):
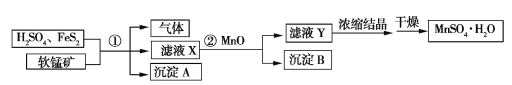
(1)已知①中只有三個反應,其中兩個反應是
MnO+H2SO4MnSO4+H2O
FeS2+H2SO4FeSO4+H2S↑+S↓
完成第三個反應:
___MnO2+___FeSO4+___ ____________MnSO4+___ _________+___ _________
(2)沉淀A、B的化學式分別是____________________、__________________。
(3)濾液X中的溶質有__________;實驗室中濃縮濾液Y時使用的玻璃儀器有___________________。
(4)若得到的沉淀A的質量和MnSO4·H2O的質量分別為96.0 g、321.1 g,②中加入的MnO為0.1 mol,則理論上軟錳礦中MnO2和MnO的物質的量之比為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎳具有良好的導磁性和可塑性,主要用于制作合金及催化劑。請回答下列問題
(1)基態鎳原子的價電子排布圖為____,同周期元素中基態原子與鎳具有相同未成對電子的還有____種。
(2)四羰基合鎳是一種無色揮發性液體,熔點-25℃,沸點43℃。則四羥基合鎳中σ鍵和π鍵數目之比為___三種組成元素按電負性由大到小的順序為____。
(3)[Ni(NH3)
4]SO4中N原子的雜化方式為____,寫出與SO42-互為等電子體的一種分子和一種離子的化學式____,____;[Ni(
NH3)4]SO4中H-N-H鍵之間的夾角___(填“>”“<”或“=”)NH3分子中H-N-H鍵之間的夾角。
(4)已知NiO的晶體結構(如圖1),可描述為:氧原子位于面心和頂點,氧原子可形成正八面體空隙和正四面體空隙,鎳原子填充在氧原子形成的空隙中,則NiO晶體中原子填充在氧原子形成的____體空隙中,其空隙的填充率為____。
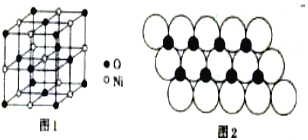
(5)一定溫度下,NiO晶體可分散形成“單分子層”,O2-作單層密置排列,Ni2+填充O2-形成的正三角形空隙中(如圖2),已知O2-的半徑為αm,每平方米面積上分數的NiO的質量為___g。(用a、NA表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用除去表面氧化膜的細鋁條緊緊纏繞在溫度計上(如圖),將少許硝酸汞溶液滴到鋁條表面,置于空氣中,很快鋁條表面產生“白毛”,且溫度明顯上升。下列分析錯誤的是

A.Al和O2化合放出熱量B.硝酸汞是催化劑
C.涉及了:2Al+3Hg2+→2Al3++3HgD.“白毛”是氧化鋁
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,對于可逆反應X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始濃度分別為c1、c2、c3(均不為零),達到平衡時,X、Y、Z的濃度分別為0.1mol·L-1、0.3mol·L-1、0.08mol·L-1,則下列判斷正確的是( )
2Z(g),若X、Y、Z的起始濃度分別為c1、c2、c3(均不為零),達到平衡時,X、Y、Z的濃度分別為0.1mol·L-1、0.3mol·L-1、0.08mol·L-1,則下列判斷正確的是( )
A. c1∶c2=3∶1
B. X、Y的轉化率不相等
C. 平衡時,Y和Z的生成速率之比為2∶3
D. c1的取值范圍為0 mol·L-1<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為測定某硬鋁(含有鋁、鎂、銅)中鋁的含量,設計了Ⅰ、Ⅱ兩個方案。根據方案Ⅰ、Ⅱ回答問題:
方案Ⅰ:
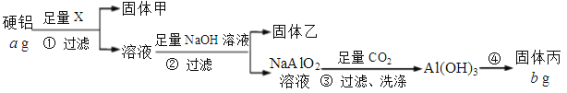
(1)固體甲是銅,試劑X的名稱是_______________。
(2)能確認NaOH溶液過量的是___________(選填選項)。
a. 測溶液pH,呈堿性
b. 取樣,繼續滴加NaOH溶液,不再有沉淀生成
c. 繼續加NaOH溶液,沉淀不再有變化
(3)步驟④的具體操作是:灼燒、_______、________,重復上述步驟至恒重。
(4)固體丙的化學式是______,該硬鋁中鋁的質量分數為_______________。
方案Ⅱ的裝置如圖所示:
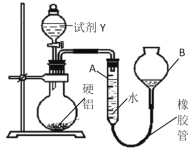
操作步驟有:
①記錄A的液面位置;
②待燒瓶中不再有氣體產生并恢復至室溫后,使A和B液面相平;
③再次記錄A的液面位置;
④將一定量Y(足量)加入燒瓶中;
⑤檢驗氣密性,將a g硬鋁和水裝入儀器中,連接好裝置。
(1)試劑Y是________________;操作順序是______________________。
(2)硬鋁質量為a g,若不測氣體的體積,改測另一物理量也能計算出鋁的質量分數,需要測定的是_______,操作的方法是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】火山爆發產生的氣體中含有少量的羰基硫(分子式是:COS),已知羰基硫分子結構與CO2類似,有關說法正確的是( )
A.羰基硫是電解質
B.羰基硫分子的電子式為:![]()
C.C、O、S三個原子中半徑最小的是C
D.羰基硫分子為非極性分子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將水分解制得氫氣的一種工業方法是“硫﹣碘循環法”,依次涉及下列三步反應:
I.SO2+2H2O+I2=H2SO4+2HI
II.2HI(g)H2(g)+I2(g)
III.2H2SO4=2SO2+O2+2H2O
(1)一定溫度下,向5L恒容密閉容器中加入1molHI,發生反應II,H2物質的量隨時間的變化如圖所示。0~2min內的平均反應速率v(HI)=___。相同溫度下,若起始加入的HI改為2mol,反應達平衡時H2的量為___mol。
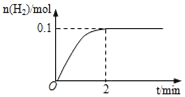
(2)分析上述反應,下列判斷錯誤的是___(填寫選項編號,只有一個正確選項)。
a.三步反應均為氧化還原反應
b.循環過程中產生1molH2,同時產生1molO2
c.在整個分解水的過程中SO2和I2相當于催化劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO和H2在一定條件下可以合成乙醇:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g),下列敘述中能說明上述反應在一定條件下已達到最大限度的是( )
CH3CH2OH(g)+H2O(g),下列敘述中能說明上述反應在一定條件下已達到最大限度的是( )
A.CO全部轉化為乙醇B.正反應和逆反應的化學反應速率均為0
C.CO和H2以1∶2的物質的量之比反應生成乙醇D.反應體系中乙醇的物質的量濃度不再變化
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com