
【題目】(1)科研人員設想用如圖所示裝置生產硫酸。
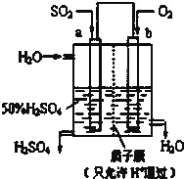
①上述生產硫酸的總反應方程式為_____,b是_____極,a電極反應式為_____,生產過程中H+向_____(填a或b)電極區域運動。
②該小組同學反思原電池的原理,其中觀點正確的是_____(填字母)。
A.原電池反應的過程中可能沒有電子發生轉移
B.原申池裝置需要2個活潑性不同的金屬電極
C.電極一定不能參加反應
D.氧化反應和還原反應可以拆開在兩極發生
(2)若需將反應:Cu+2Fe3+=Cu2++2Fe2+設計成原電池裝置,則負極材料為_____,溶液C為_____。
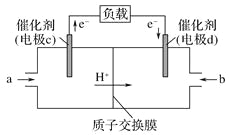
(3)CO與H2反應還可制備CH3OH,CH3OH可作為燃料使用,用CH3OH和O2組合形成的質子交換膜(只允許H+通過)燃料電池的結構示意圖如:電池總反應為2CH3OH+3O2=2CO2+4H2O,c電極為_____(填“正極”或“負極”),c電極反應方程式為_________。
【答案】2SO2+O2+2H2O=2H2SO4 ![]() SO2-2e-+2H2O=4H++SO42- b D Cu FeCl3溶液 負 CH3OH-6e-+H2O=CO2+6H+
SO2-2e-+2H2O=4H++SO42- b D Cu FeCl3溶液 負 CH3OH-6e-+H2O=CO2+6H+
【解析】
(1)原電池中負極失去電子,發生氧化反應。電子經導線傳遞到正極,所以溶液中的陽離子向正極移動,正極得到電子,發生還原反應,據此判斷;
(2)根據原電池的工作原理分析解答;
(3)根據電子的移動方向判斷正負極,進而書寫電極反應式。
(1)①根據裝置圖可知a電極通入二氧化硫,二氧化硫發生失去電子的氧化反應,氧氣在正極通入,因此上述生產硫酸的總反應方程式為2SO2+O2+2H2O=2H2SO4,b通入氧氣,是正極,a電極是負極,反應式為SO2-2e-+2H2O=4H++SO42-,原電池中陽離子向正極移動,則生產過程中H+向b電極區域運動。
②A.原電池反應的過程中一定有電子發生轉移,A錯誤;
B.原申池裝置不一定需要2個活潑性不同的金屬電極,例如燃料電池等,B錯誤;
C.原電池中電極可以參加反應,例如銅、鋅、稀硫酸組成的原電池中鋅電極參加反應,C錯誤;
D.原電池中氧化反應和還原反應可以拆開在兩極發生,D正確;
答案選D。
(2)根據反應Cu+2Fe3+=Cu2++2Fe2+可知銅失去電子,鐵離子得到電子,則設計成原電池裝置時負極材料為Cu,溶液C為氯化鐵溶液。
(3)根據裝置圖可知電子從c電極流出,則c電極是負極,電池總反應為2CH3OH+3O2=2CO2+4H2O,所以甲醇在負極發生失去電子的氧化反應轉化為二氧化碳,則c電極反應方程式為CH3OH-6e-+H2O=CO2+6H+。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.可用濕潤的紅色石蕊試紙檢測氨氣
B.NH3能使酚酞溶液變紅,所以NH3可用于設計噴泉實驗
C.少量的CO2通人氨水中:CO2+NH3·H2O=NH4++HCO3-
D.P2O5可用于干燥Cl2和NH3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學研究性學習小組對某無色水樣的成分進行檢驗,已知該水樣中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO![]() 、SO
、SO![]() 、Cl﹣中的若干種離子.該小組同學取100mL水樣進行實驗,向水樣中先滴加硝酸鋇溶液,再滴加1mol/L的硝酸,實驗過程中沉淀質量的變化情況如下圖所示:(提示:Al3+與CO
、Cl﹣中的若干種離子.該小組同學取100mL水樣進行實驗,向水樣中先滴加硝酸鋇溶液,再滴加1mol/L的硝酸,實驗過程中沉淀質量的變化情況如下圖所示:(提示:Al3+與CO![]() 不共存)
不共存)

(1)水樣中一定含有的陰離子是_____,其物質的量濃度之比為_____.
(2)寫出BC段所表示反應的離子方程式:_____.
(3)由B到C點變化過程中消耗硝酸的體積為_____.
(4)試根據實驗結果推測K+是否存在?_____(填“是”或“否”);若存在,K+的物質的量濃度c(K+)的范圍是_____.(若K+不存在,則不必回答該問).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】食鹽(NaCl)是生活中常用的調味品,胃酸的主要成分是鹽酸。下列關于兩種物質的說法正確的是( )
A. 炒菜時放入食鹽并不破壞NaCl中的化學鍵
B. 胃舒平(主要成分氫氧化鋁)與胃酸反應生成的AlCl3屬于離子化合物
C. NaCl熔化時破壞共價鍵
D. 鹽酸中的溶質HCl屬于共價化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某科研機構用NaOH溶液吸收硫酸工業廢氣中的SO2,將所得的Na2SO3溶液進行電解,可循環再生NaOH,同時得到某種副產物,其原理如圖所示(電極材料為石墨)。

(1)當有1molNa+通過陽離子交換膜時,a極生成氣體__________L(標準狀況),陽極的電極反應式是______________________________。
(2)稀NaOH溶液的作用是____________,B處流出較濃的NaOH溶液,C處流出的是________________。
(3)在標準狀況下,若用甲烷-空氣燃料電池做電源,處理含SO2 20%(體積分數)的廢氣40m3,理論上需要消耗甲烷___________m3。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是周期表中短周期的一部分,A、B、C三種元素的原子核外電子數之和等于B的質量數,B元素的原子核內質子數等于中子數,下列敘述正確的是( )
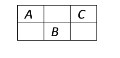
A. B為第二周期的元素
B. C為VA族元素
C. 三種元素都為非金屬元素
D. B是三者中化學性質最活潑的非金屬
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,向一個容積為3L的真空密閉容器中通入1molN2和3molH2,2min后,測得容器內的壓強是開始時的0.8倍,則這段時間內V(H2)為( )
A.0.2mol/(L·min)B.0.6mol/(L·min)
C.0.1mol/(L·min)D.0.3mol/(L·min)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,針對表中的①~⑩中元素,用元素符號或化學式填空回答以下問題:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)化學性質最不活潑的元素原子的原子結構示意圖為________;
(2)比較元素①、②的簡單氫化物的穩定性______________________(用化學式表示);
(3)元素的最高價氧化物對應的水化物中酸性最強的是________,堿性最強的是_______,呈兩性的氫氧化物是_______________,(填寫化學式) 元素③的最高價氧化物對應水化物中含有的化學鍵類型為________________;
(4)在③~⑦元素中,簡單離子半徑最小的是_________;
(5) Na2O2的電子式為___________;CO2的電子式為_________;
(6)在⑦與⑩的單質中,氧化性較強的是_______________,用化學反應方程式證明:_____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 是重要的核工業原料。下列有關
是重要的核工業原料。下列有關![]() 、
、![]() 說法正確的是
說法正確的是
A. ![]() 原子核中含有92個中子 B.
原子核中含有92個中子 B. ![]() 原子核外有143個電子
原子核外有143個電子
C. ![]() 與
與![]() 互為同位素 D.
互為同位素 D. ![]() 與
與![]() 互為同素異形體
互為同素異形體
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com