
【題目】一水硫酸四氨合銅晶體[Cu(NH3)4SO4·H2O,相對分子質量為246]是一種重要的染料及農藥中間體。常溫下該物質可溶于水,難溶于乙醇。某化學興趣小組通過以下實驗制備一水硫酸四氨合銅晶體并測定其純度。回答相關問題:
I.實驗室制取CuSO4溶液
方案i:銅與濃硫酸加熱制備。
方案ii:將銅粉在空氣中充分加熱至完全變黑,再加稀硫酸即可得到硫酸銅溶液。
(1)請寫出方案i反應的化學方程式____,其缺點是____(寫1點)。
(2)實際生產中方案ii常常有紫紅色固體未反應,猜想原因可能是____。
(3)基于此,實驗進行了改進,其中一種方案是在硫酸和銅的反應容器中滴加H2O2溶液,觀察到的現象是____(寫1點)。H2O2的沸點為150.2℃。為加快反應需要提高H2O2溶液的濃度,可通過下圖將H2O2稀溶液濃縮,冷水入口是____(填a或b),增加減壓設備的目的是____。
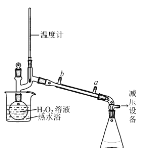
II.一水硫酸四氨合銅晶體的制備
(4)硫酸銅溶液含有一定的硫酸,呈酸性,加入適量NH3·H2O調節溶液pH,產生淺藍色沉淀,已知其成分為Cu2(OH)2SO4,試寫出生成此沉淀的離子反應方程式__________。
(5)繼續滴加NH3·H2O,會轉化成深藍色溶液。從深藍色溶液中析出深藍色晶體的簡便實驗是滴加____________。
III.產品純度的測定
(6)精確稱取mg晶體,加適量水溶解,然后逐滴加入足量NaOH溶液,通入水蒸氣將氨全部蒸出,用V1mL0.200mol·L-1的鹽酸完全吸收。以甲基橙作指示劑,用0.200mol·L-1NaOH標準溶液滴定過剩的HCl,到終點時消耗V2mLNaOH溶液。產品純度的表達式為______。
【答案】Cu+2H2SO4(濃)![]() CuSO4+ SO2↑+2H2O 會產生有污染的SO2氣體(或硫酸利用率比較低或不節能) 表面生成的CuO阻止內部銅與O2接觸或反應 銅溶解、溶液變藍、產生氣泡 a 降低水的沸點,避免H2O2分解 2Cu2++2NH3·H2O+SO42-=Cu2(OH)2SO4↓+2NH4+ 乙醇
CuSO4+ SO2↑+2H2O 會產生有污染的SO2氣體(或硫酸利用率比較低或不節能) 表面生成的CuO阻止內部銅與O2接觸或反應 銅溶解、溶液變藍、產生氣泡 a 降低水的沸點,避免H2O2分解 2Cu2++2NH3·H2O+SO42-=Cu2(OH)2SO4↓+2NH4+ 乙醇 ![]() =
=![]()
【解析】
(1)方案i銅與濃硫酸加熱反應生成硫酸銅、二氧化硫和水,化學方程式Cu+2H2SO4(濃)![]() CuSO4+ SO2↑+2H2O,其缺點是會產生有污染的SO2氣體(或硫酸利用率比較低或不節能)(寫1點)。故答案為:Cu+2H2SO4(濃)
CuSO4+ SO2↑+2H2O,其缺點是會產生有污染的SO2氣體(或硫酸利用率比較低或不節能)(寫1點)。故答案為:Cu+2H2SO4(濃)![]() CuSO4+ SO2↑+2H2O;會產生有污染的SO2氣體(或硫酸利用率比較低或不節能);
CuSO4+ SO2↑+2H2O;會產生有污染的SO2氣體(或硫酸利用率比較低或不節能);
(2)實際生產中方案ii常常有紫紅色固體未反應,猜想原因可能是表面生成的CuO阻止內部銅與O2接觸或反應。故答案為:表面生成的CuO阻止內部銅與O2接觸或反應;
(3)在硫酸和銅的反應容器中滴加H2O2溶液,Cu在H2O2作用下與稀硫酸反應生成硫酸銅,該反應的化學方程式為:Cu+H2O2+H2SO4═CuSO4+H2O,觀察到的現象是銅溶解、溶液變藍、產生氣泡(寫1點)。H2O2的沸點為150.2℃。為加快反應需要提高H2O2溶液的濃度,可通過減壓蒸餾將H2O2稀溶液濃縮,冷凝水逆流時熱交換效率高,冷水入口是a(填a或b),過氧化氫受熱易分解,故采用減壓蒸餾的方式,增加減壓設備的目的是降低水的沸點,避免H2O2分解。
故答案為:銅溶解、溶液變藍、產生氣泡;a;降低水的沸點,避免H2O2分解;
II.(4)硫酸銅溶液含有一定的硫酸,呈酸性,加入適量NH3·H2O調節溶液pH,產生淺藍色沉淀Cu2(OH)2SO4,生成此沉淀的離子反應方程式2Cu2++2NH3·H2O+SO42-=Cu2(OH)2SO4↓+2NH4+ 。故答案為:2Cu2++2NH3·H2O+SO42-=Cu2(OH)2SO4↓+2NH4+ ;
(5)繼續滴加NH3·H2O,會轉化成深藍色溶液。由于Cu(NH3)4SO4·H2O晶體難溶于乙醇,可溶于水,從深藍色溶液中析出深藍色晶體的簡便實驗是滴加乙醇。故答案為:乙醇;
III.(6)與氨氣反應的n(HCl)=10-3V1L×0.200mol·L-1-0.200mol·L-1×10-3V2L=2×10-4(V1-V2)mol,根據NH3~HCl可知,n(NH3)=n(HCl)=2×10-4(V1-V2)mol,則n[Cu(NH3)4SO4·H2O]=![]() n(NH3)=5×10-5(V1-V2)mol,樣品中產品純度的表達式為:
n(NH3)=5×10-5(V1-V2)mol,樣品中產品純度的表達式為:![]() =
=![]() =
=![]() 。
。
故答案為:![]() =
=![]() 。
。


科目:高中化學 來源: 題型:
【題目】下列反應中不是氧化還原反應的是( )
A.2KMnO4 +16HCl(濃) = 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O
B.2NaHCO3 ![]() Na2CO3 + H2O + CO2↑
Na2CO3 + H2O + CO2↑
C.Cl2 + SO2 + 2H2O = H2SO4 + 2HCl
D.2Na + 2H2O = 2NaOH + H2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某化學反應的平衡常數表達式為K=![]() ,在不同的溫度下該反應的平衡常數如表所示:
,在不同的溫度下該反應的平衡常數如表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有關敘述不正確的是( )
A. 該反應的化學方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 上述反應的正反應是放熱反應
C. 若在1L的密閉容器中通入CO2和H2各1mol,5min后溫度升高到830℃,此時測得CO2為0.4mol時,該反應達到平衡狀態
D. 若平衡濃度符合下列關系式:![]() ,則此時的溫度為1000℃
,則此時的溫度為1000℃
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式中,只能表示一個化學反應的是( )
①Ag++Cl﹣=AgCl↓ ②Ba2++2OH﹣+2H++![]() =BaSO4↓+2H2O③
=BaSO4↓+2H2O③![]() +2H+===CO2↑+H2O ④Fe+Cu2+===Fe2++Cu
+2H+===CO2↑+H2O ④Fe+Cu2+===Fe2++Cu
A.①③B.②④C.②③D.沒有
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】通常人們把拆開1 mol某化學鍵所吸收的能量看成該化學鍵的鍵能,鍵能的大小可用于估算化學反應的反應熱(ΔH),已知如下化學鍵的鍵能:
化學鍵 | H—H | Cl—Cl | H—Cl |
生成1 mol化學鍵時放出的能量 | 436kJ/mol | 243kJ/mol | 431kJ/mol |
則下列熱化學方程式不正確的是
A.![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g) ΔH=-91.5kJ/mol
Cl2(g)=HCl(g) ΔH=-91.5kJ/mol
B.H2(g)+Cl2(g)=2HCl(g) ΔH=-183kJ/mol
C.2HCl(g)=H2(g)+Cl2(g) ΔH=+183kJ/mol
D.![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g) ΔH=+91.5kJ/mol
Cl2(g)=HCl(g) ΔH=+91.5kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】117號元素Ts的原子最外層電子數是7,下列說法不正確的是
A.Ts是第七周期第ⅦA族元素B.還原性:I<Ts
C.原子半徑:I<TsD.中子數為176的Ts的核素符號:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海帶中提取碘單質,成熟的工藝流程如下

下列關于海水制碘的說法,正確的是
A. 實驗室在蒸發皿中灼燒干海帶,并且用玻璃棒攪拌
B. 可用酒精萃取碘水中的I2
C. 沸水浸泡海帶灰的目的是為了加快I-的溶解,并使之溶解更充分
D. 含I-的濾液中加入稀硫酸和雙氧水后,碘元素發生還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高溫下鋁粉與氧化鐵的反應可以用來焊接鋼軌,該反應會放出大量的熱,使置換出的鐵呈熔融態,從而達到焊接目的。下列分析錯誤的是
A.該反應不屬于氧化還原反應
B.被還原的物質是氧化鐵
C.該反應的還原劑是鋁粉
D.該反應可以用來冶煉某些熔點高的金屬
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸亞鐵銨[(NH4)2Fe(SO4)2]是分析化學中的重要試劑,在不同溫度下加熱分解所得產物不同。設計如圖實驗裝置(夾持裝置略去),在500℃時隔絕空氣加熱A中的硫酸亞鐵銨至分解完全,確定分解產物(鐵的氧化物、硫的氧化物、含氮物質、水)的具體成分(已知每個裝置中的藥品足量)。
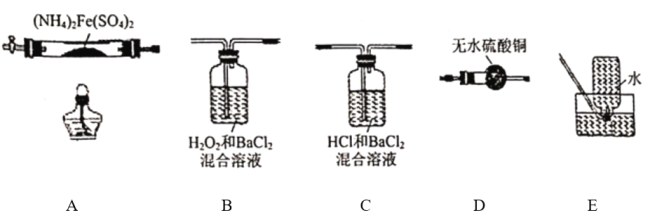
(1)利用上述裝置完成該實驗,則該裝置的正確連接順序為_______________(用裝置下面的字母填連接順序,每個裝置都要使用)。加熱A前需要通入一段時間N2目的是_______________。
(2)若觀察到B中有白色沉淀生成,C中無明顯現象,則裝置C的作用為_______________,D中白色變為藍色,寫出B中發生反應的離子方程式_______________裝置B與裝置C能否互換_______________(填 “能”或“否”),原因是_______________(填“能”則不填此空)。
(3)A中固體完全分解后變為紅棕色粉末,某同學設計實驗驗證固體殘留物僅為Fe2O3,而不含FeO,請幫他完成表中內容(試劑,儀器和用品自選)。
實驗步驟 | 預期現象 | 結論 |
_______________ | _______________ | 固本殘留物僅為Fe2O3 |
(4)硫酸亞鐵銨在500℃時隔絕空氣加熱完全分解,若E中收集到的氣體只有N2,A中固體殘留物Fe2O3的質量為80g,B中沉淀物質的量為2rnol,則生成N2的質量為_______________g。
(5)某含鉻(Cr2O72-)廢水用硫酸亞鐵銨溶液滴定處理,反應后鐵元素和鉻元素完全轉化為沉淀(沉淀中鉻元素化合價為+3),該沉淀經干燥后得到amolFeOFemCrnO3,不考慮處理過程中的實際損耗,則消耗硫酸亞鐵銨的物質的量為_______________mol(用a的代數式表示)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com