
【題目】氮元素能夠形成多種化合物。請回答下列問題:
(1)連氨(N2H4)常溫下為液態,在空氣中迅速完成燃燒生成N2,同時放出大量熱,可作導彈、宇航飛船、火箭的燃料。
已知:H2(g)+![]() O2(g)═H2O(l)△H1=-285.8kJmol-1
O2(g)═H2O(l)△H1=-285.8kJmol-1
N2(g)+2H2(g)═N2H4(l)△H2=+50.6kJmol-1
則N2H4(l)在空氣燃燒生成液態水的熱化學方程式為______。
(2)工業上利用氨氣生產氫氰酸(HCN)的反應CH4(g)+NH3(g)HCN(g)+3H2(g)△H>0。一定溫度下,向2L恒容容器中充入1molCH4(g)和2molNH3(g)發生上述反應,4min達到平衡時,測得CH4的轉化率為![]() 。0-4min內,用H2表示的該反應速率v(H2)=______。
。0-4min內,用H2表示的該反應速率v(H2)=______。
保持溫度和容積不變,再向平衡后的容器中充入2molNH3和2molH2,此時v正______v逆(選填“>”“<”或“=”)。
(3)NH3能夠形成Ag(NH3)2+。
①溶液中存在Ag+(aq)+2NH3(aq)Ag(NH3)2+(aq),其平衡常數的表達式為K穩=______。
②常溫下,K穩[Ag(NH3)2+]=1.10×107,反應AgCl(s)+2NH3(aq)Ag(NH3)2+(aq)+Cl-(aq)的化學平衡常數K=1.936×10-3,則Ksp(AgCl)=______。
(4)硫氧化物和氮氧化物是常見的大氣污染物,利用如圖所示裝置(電極均為惰性電極)可吸收SO2,并用陰極排出的溶液吸收NO2。
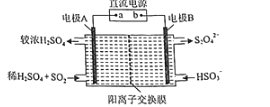
①電極A的電極反應式為______。
②在堿性條件下,用陰極排出的溶液吸收NO2,使其轉化為無害氣體,同時有SO32-生成。該反應離子方程式為______。
【答案】N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-622.2kJ/mol 0.25mol/(Lmin) > 1.76×10-10 SO2+2H2O-2e-=SO42-+4H+ 2NO2+8OH-+4S2O42-=N2+8SO32-+4H2O 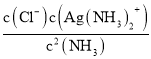
【解析】
(1)已知:①H2(g)+![]() O2(g)═H2O(l)△H1=-285.8kJmol-1
O2(g)═H2O(l)△H1=-285.8kJmol-1
②N2(g)+2H2(g)=N2H4(l)△H2=+50.6kJ/mol
蓋斯定律計算①×2-②得到N2H4(l)在空氣燃燒生成液態水的熱化學方程式;
(2)①CH4(g)+NH3(g)HCN(g)+3H2(g)△H>0,計算甲烷反應的物質的量,通過化學方程式三行計算列式得到計算生成氫氣物質的量,反應速率v(H2)=![]() ,計算平衡常數,保持溫度和容積不變,再向平衡后的容器中充入2molNH3和2molH2,計算此時濃度商和平衡常數比較判斷反應進行的方向;
,計算平衡常數,保持溫度和容積不變,再向平衡后的容器中充入2molNH3和2molH2,計算此時濃度商和平衡常數比較判斷反應進行的方向;
(3)溶液中存在Ag+(aq)+2NH3(aq)Ag( NH3)2+(aq )時,平衡常數K=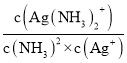 ;常溫下,K穩[Ag(NH3)2+]=1.10×107,反應AgCl (s)+2NH3(aq)Ag( NH3)2+(aq)+Cl-(aq)的化學平衡常數K=1.936×10-3,結合平衡常數K=
;常溫下,K穩[Ag(NH3)2+]=1.10×107,反應AgCl (s)+2NH3(aq)Ag( NH3)2+(aq)+Cl-(aq)的化學平衡常數K=1.936×10-3,結合平衡常數K=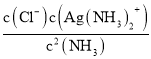 =
=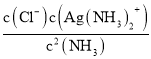 ×
×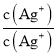 =Ksp(AgCl)K穩[Ag(NH3)2+];
=Ksp(AgCl)K穩[Ag(NH3)2+];
(4)陽極發生氧化反應,陽極上是二氧化硫被氧化為硫酸根,A為陽極,在堿性條件下,用陰極排出的溶液吸收NO2,使其轉化為無害氣體N2,同時有SO42-生成,結合電話守恒電子守恒和原子守恒寫出離子方程式。
(1)已知:①H2(g)+![]() O2(g)═H2O(l)△H1=-285.8kJmol-1,
O2(g)═H2O(l)△H1=-285.8kJmol-1,
②N2(g)+2H2(g)=N2H4(l)△H2=+50.6kJ/mol,
蓋斯定律計算①×2-②得到N2H4(l)在空氣燃燒生成液態水的熱化學方程式:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-622.2kJ/mol;
(2)①一定溫度下,向2L恒容容器中充入1mol CH4(g)和2mol NH3(g)發生上述反應,4min達到平衡時,測得CH4的轉化率為66.67%.反應的甲烷物質的量=1mol×66.67%=![]() mol,CH4(g)+NH3(g)HCN(g)+3H2(g)計算得到生成氫氣物質的量=
mol,CH4(g)+NH3(g)HCN(g)+3H2(g)計算得到生成氫氣物質的量=![]() mol×3=2mol,0~4min內,用H2表示的該反應速率v(H2)=
mol×3=2mol,0~4min內,用H2表示的該反應速率v(H2)=![]() =0.25ol/(Lmin),
=0.25ol/(Lmin),

平衡常數K= 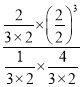 =3,保持溫度和容積不變,再句平衡后的容器中充入2molNH3和2molH2,此時濃度商Qc=
=3,保持溫度和容積不變,再句平衡后的容器中充入2molNH3和2molH2,此時濃度商Qc=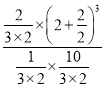 =2.4<K=3,平衡正向進行,v正>v逆;
=2.4<K=3,平衡正向進行,v正>v逆;
(3)溶液中存在Ag+(aq)+2NH3(aq)═Ag( NH3)2+(aq )時,平衡常數K=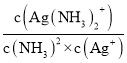 ;常溫下,K穩[Ag(NH3)2+]=1.10×107,反應AgCl (s)+2NH3(aq)Ag( NH3)2+(aq)+Cl-(aq)的化學平衡常數K=1.936×10-3,結合平衡常數K=
;常溫下,K穩[Ag(NH3)2+]=1.10×107,反應AgCl (s)+2NH3(aq)Ag( NH3)2+(aq)+Cl-(aq)的化學平衡常數K=1.936×10-3,結合平衡常數K=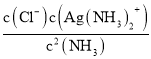 =
=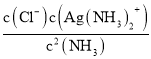 ×
×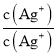 =Ksp(AgCl)K穩[Ag(NH3)2+]=1.936×10-3,Ksp(AgCl)=
=Ksp(AgCl)K穩[Ag(NH3)2+]=1.936×10-3,Ksp(AgCl)=![]() =1.76×10-10;
=1.76×10-10;
(4)①A為陽極,陽極發生氧化反應,陽極上是二氧化硫被氧化為硫酸根,陽極電極反應式為:SO2+2H2O-2e-=SO42-+4H+;
②在堿性條件下,用陰極排出的溶液吸收NO2,使其轉化為無害氣體N2,同時有SO32-生成,該應的離子方程式為:2NO2+8OH-+4S2O42-=N2+8SO32-+4H2O。


 口算題卡北京婦女兒童出版社系列答案
口算題卡北京婦女兒童出版社系列答案科目:高中化學 來源: 題型:
【題目】以含鋰電解鋁廢渣(主要含 AlF3、 NaF、LiF、CaO ) 和濃硫酸為原料,制備電池級碳酸鋰,同時得副產品冰晶石,其工藝流程如下:

已知LiOH易溶于水,Li2CO3微溶于水。回答下列問題:
(1)電解鋁廢渣與濃硫酸反應產生的氣體化學式為 ___________。濾渣2的主要成分是(寫化學式)_________。
(2)堿解反應中, 同時得到氣體和沉淀反應的離子方程式為_____________。
(3)一般地說 K>105 時,該反應進行得就基本完全了。苛化反應中存在如下平衡:Li2CO3(s)+Ca2+(aq)2Li+(aq)+ CaCO3(s)通過計算說明該反應是否進行完全________(已知Ksp(Li2CO3) = 8.64×10-4、Ksp(CaCO3) = 2.5×10-9)。
(4)碳化反應后的溶液得到Li2CO3的具體實驗操作有:加熱濃縮、______、______、干燥。
(5)上述流程得到副產品冰晶石的化學方程式為__________。
(6)Li2CO3是制備金屬鋰的重要原料, 一種制備金屬鋰的新方法獲得國家發明專利,其裝置如圖所示:

工作時電極 C 應連接電源的______極,陽極的電極反應式為__________ 。該方法設計的 A 區能避免熔融碳酸鋰對設備的腐蝕和因________逸出對環境的污染。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列涉及化學學科觀點的有關說法正確的是![]()
A. 微粒觀:二氧化硫是由硫原子和氧原子構成的
B. 轉化觀:升高溫度可以將不飽和硝酸鉀溶液轉變為飽和
C. 守恒觀:1g鎂與1g稀硫酸充分反應后所得的溶液質量為2g
D. 結構觀:金剛石和石墨由于結構中碳原子的排列方式不同,性質存在著較大的差異
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】焦亞硫酸鈉(Na2S2O5)可作為貯存水果的保鮮劑。現欲制備焦亞硫酸鈉并探究其部分化學性質。
Ⅰ.制備Na2S2O5
可用試劑:飽和Na2SO3溶液、濃NaOH溶液、濃H2SO4、苯、Na2SO3固體(試劑不重復使用)。
焦亞硫酸鈉的析出原理:2NaHSO3(飽和溶液)=Na2S2O5(晶體)+H2O(l)
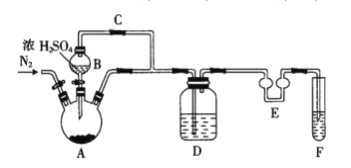
(1)如圖裝置中儀器A的名稱是___。A中發生反應的化學方程式為___。儀器E的作用是___。
(2)F中盛裝的試劑是___。
Ⅱ.探究Na2S2O5的還原性
(3)取少量Na2S2O5晶體于試管中,滴加1mL2mol/L酸性KMnO4溶液,劇烈反應,溶液紫紅色很快褪去。反應的離子方程式為___。食品級焦亞硫酸鈉可作為貯存水果保鮮劑的化學原理是防止食品___。
Ⅲ.測定Na2S2O5樣品的純度。
(4)將10.0gNa2S2O5樣品溶解在蒸餾水中配制100mL溶液,取其中10.00mL加入過量的20.00mL0.3000mol/L的酸性高錳酸鉀溶液,充分反應后,用0.2500mol/L的Na2SO3標準液滴定至終點,消耗Na2SO3溶液20.00mL,Na2S2O5樣品的純度為___%(保留一位小數),若在滴定終點時,俯視讀數Na2SO3標準液的體積,會導致Na2S2O5樣品的純度___。(填“偏高”、“偏低”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】普通水泥在固化過程中其自由水分子減少并形成堿性溶液.根據這一物理化學特點,科學家發明了電動勢法測水泥的初凝時間.此法的原理如圖所示,反應的總方程式為2Cu+Ag2O═Cu2O+2Ag,下列有關說法正確的是( )

A.2molCu與1molAg2O的總能量低于1molCu2O與2molAg具有的總能量
B.負極的電極反應式為2Cu+2OH--2e-═Cu2O+H2O
C.測量原理示意圖中,電流方向從Cu→Ag2O
D.電池工作時,OH-向正極移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以NOx 為主要成分的霧霾的綜合治理是當前重要的研究課題。
I.汽車尾氣中的 NO(g)和 CO(g)在一定條件下可發生反應生成無毒的N2 和 CO2:
(1)已知:①N2(g)+O2(g)![]() 2NO(g) △H1= +180.5 kJ·mol-1 ②CO 的燃燒熱△H2 = - 283.0 kJ·mol-l,則反應③ 2NO(g)+2CO(g)
2NO(g) △H1= +180.5 kJ·mol-1 ②CO 的燃燒熱△H2 = - 283.0 kJ·mol-l,則反應③ 2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H3 =_______。
N2(g)+2CO2(g) △H3 =_______。
(2)某研究小組在三個容積為 5 L 的恒容密閉容器中,分別充入 0.4mol NO 和 0.4 mol CO,發生反應③ 。在三種不同實驗條件下進行上述反應(體系各自保持溫度不變),反應體系總壓強隨時間的變化如圖所示:
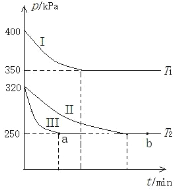
①溫度:T1_____T2(填“<”“=”或“>”)。
②CO 的平衡轉化率:Ⅰ_____Ⅱ_____Ⅲ(填“<”“=”或“>”)。
③反應速率:a 點的 v逆_____b 點的 v正 (填“<”“=”或“>”)。
④T2 時的平衡常數 Kc=_____。
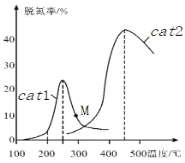
(3)將 NO和 CO以一定的流速通過兩種不同的催化劑(cat1、cat2)進行反應,相同時間內測量的脫氮率(脫氮率即 NO的轉化率)如圖所示。M 點_____(填“是”或“不是”)對應溫度下的平衡脫氮率, 說明理由_________。
Ⅱ.N2O是一種強溫室氣體,且易形成顆粒性污染物,研究N2O的分解反應 2N2O=2N2+O2對環境保護有重要意義。
(4)碘蒸氣存在能大幅度提高 N2O 的分解速率,反應歷程為:
第一步 I2(g)![]() 2I(g)快速平衡,平衡常數為K
2I(g)快速平衡,平衡常數為K
第二步 I(g)+N2O(g)→N2(g)+IO(g) v = k1·c(N2O)·c(I) 慢反應
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+1/2I2(g) 快反應
其中可近似認為第二步反應不影響第一步的平衡。實驗表明,含碘時N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k為速率常數)。
① k =_____(用含 K 和 k1 的代數式表示)。
②下列表述正確的是_____。
a.IO 為反應的中間產物
b.碘蒸氣的濃度大小不會影響 N2O的分解速率
c.第二步對總反應速率起決定作用
d.催化劑會降低反應的活化能,從而影響△H
(5)通過 N2O 傳感器可監測環境中 N2O 的含量,其工作原理如圖所示
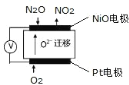
①NiO電極上的電極反應式為_____。
②N2O濃度越高,則電壓表讀數越_____。(填“高”或“低”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋇在氧氣中燃燒時得到一種鋇的氧化物晶體,結構如圖所示,有關說法不正確的是( )

A. 該晶體屬于離子晶體
B. 晶體的化學式為Ba2O2
C. 該晶體晶胞結構與NaCl相似
D. 與每個Ba2+距離相等且最近的Ba2+共有12個
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙炔是一種重要的有機化工原料,以乙炔為原料在不同的反應條件下可以轉化成以下化合物:
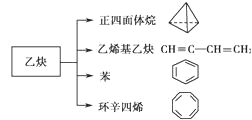
下列說法正確的是( )
A.1mol乙烯基乙炔能與 3mol Br2發生加成反應
B.正四面體烷二氯取代產物只有1種
C.環辛四烯核磁共振氫譜有2組峰
D.環辛四烯與苯互為同系物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向某Na2CO3、NaHCO3的混合溶液中加入少量的BaCl2固體(溶液體積變化、溫度變化忽略不計),測得溶液中離子濃度的關系如圖所示,下列說法正確的是( )
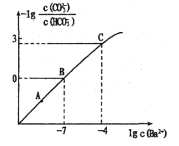
已知:Ksp(BaCO3)=2.40![]() 10-9
10-9
A.A、B、C三點對應溶液pH的大小順序為:A>B>C
B.A點對應的溶液中存在:c(CO32-)< c(HCO3-)
C.B點溶液中 c(CO32-)=0.24mol/L
D.向C點溶液中通入CO2可使C點溶液向B點溶液轉化
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com