
【題目】鐵及其化合物在生產和生活中有著廣泛的應用。
I.氧化鐵是重要工業(yè)顏料,用廢鐵屑制備它的流程如下:

回答下列問題:
(1)操作A、B的名稱分別是______、_____;加入稍過量的NH4HCO3溶液的作用是_______。
(2)寫出在空氣中充分加熱煅燒FeCO3的化學方程式:__________。
II.上述流程中,若煅燒不充分,最終產品中會含有少量的FeO雜質。某同學為測定產品中Fe2O3的含量,進行如下實驗:
a.稱取樣品8.00g,加入足量稀H2SO4溶解,并加水稀杯至100mL;
b.量取25.00mL待測溶液于錐形瓶中;
c.用酸化的0.01000mol·L-1KMnO4標準液滴定至終點;
d.重復操作b、c2~3次,得出消耗KMnO4溶液體積的平均值為20.00mL.
(3)寫出滴定過程中發(fā)生反應的離子方程式:_________。
(4)確定滴定達到終點的操作及現象為_________。
(5)上述樣品的質量分數為_________。
(6)下列操作會導致樣品中Fe2O3的質量分數的測定結果偏低的有______。
a.未干澡錐形瓶 b.盛裝標準液的滴定管沒有用標準液潤洗
c.滴定結束時仰視刻度線讀數 d.量取待測液的滴定管沒有潤洗
【答案】 過濾 洗滌 調節(jié)溶液的pH,使溶液中的Fe2+完全沉淀為FeCO3 4 FeCO3 +O2=2Fe2O3+4CO2 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 向待測液中再滴加一滴標準液時,振蕩,溶液剛好由黃色變成淺紫色,且半分鐘內不褪去 96.4% b、c
【解析】(1)操作I后得到濾渣和濾液,所以應為過濾,沉淀干燥前應先洗滌除去雜質。加入NH4HCO3溶液得到碳酸亞鐵,因此加入稍過量的NH4HCO3溶液的作用是調節(jié)溶液的pH,使溶液中的Fe2+完全沉淀為FeCO3。(2)+2價鐵在空氣中加熱易被氧化為+3價,即Fe2O3,根據原子守恒還有CO2產生,因此在空氣中充分加熱煅燒FeCO3的化學方程式為4FeCO3 +O2![]() 2Fe2O3+4CO2;(3)亞鐵離子被酸性高錳酸具有溶液氧化的離子方程式為5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;(4)酸性高錳酸鉀溶液顯紫紅色,則終點實驗現象是:向待測液中再滴加一滴標準液時,振蕩,溶液剛好由黃色變成淺紫色,且半分鐘內不褪去;(5)消耗高錳酸鉀是0.0002mol,根據方程式可知亞鐵離子是0.001mol,因此原物質中亞鐵離子是0.001mol×100mL/25mL=0.004mol,氧化亞鐵質量是0.004mol×72g/mol=0.288g,則氧化鐵的質量分數是
2Fe2O3+4CO2;(3)亞鐵離子被酸性高錳酸具有溶液氧化的離子方程式為5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;(4)酸性高錳酸鉀溶液顯紫紅色,則終點實驗現象是:向待測液中再滴加一滴標準液時,振蕩,溶液剛好由黃色變成淺紫色,且半分鐘內不褪去;(5)消耗高錳酸鉀是0.0002mol,根據方程式可知亞鐵離子是0.001mol,因此原物質中亞鐵離子是0.001mol×100mL/25mL=0.004mol,氧化亞鐵質量是0.004mol×72g/mol=0.288g,則氧化鐵的質量分數是![]() ;(6)a、錐形瓶內有水對結果無影響;b、滴定管未潤洗相當于將標準液稀釋,所用標準液體積增大,故結果偏小;c、滴定結束時仰視刻度線讀數,讀取體積偏大,結果偏小;d、量取待測液的滴定管沒有潤洗,消耗標準液體積偏小,結果偏高。答案選bc。
;(6)a、錐形瓶內有水對結果無影響;b、滴定管未潤洗相當于將標準液稀釋,所用標準液體積增大,故結果偏小;c、滴定結束時仰視刻度線讀數,讀取體積偏大,結果偏小;d、量取待測液的滴定管沒有潤洗,消耗標準液體積偏小,結果偏高。答案選bc。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】溴苯是一種常用的化工原料。實驗室制備溴苯的實驗步驟如下:

步驟1:在a中加入20mL苯和少量鐵屑,再將b中4.0 mL液溴慢慢加入到a中充分反應.將b 中的液溴慢慢加入到a中,而不能快速加入的原因是_______________。繼續(xù)滴加液溴至完全加入。裝置d的作用是___________________。
步驟2:向a中加入15mL水,然后_____________(填操作名稱)除去未反應的鐵屑。
步驟3:再依次用10mL水、8mL10%的Na0H溶液、10mL水洗滌,分液得粗溴苯。Na0H溶液洗滌的作用是________________。
步驟4:向分出的粗溴苯中加入少量的無水氯化鈣.靜置、過濾即得粗產品。加入氯化鈣的目的是_______。
已知溴、苯、溴苯的有關物理性質如下表:
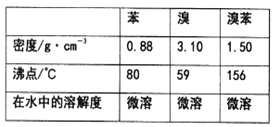
(1)實驗裝置中,儀器c的名稱為______________,作用是冷凝回流.回流的主要物質有_______________(填化學式)。
(2)步驟4得到的粗產品中還含有雜質苯,則要進一步提純粗產品,還必須進行的實驗操作名稱是_______________。
(3)在該實驗中,a的容積最適合的是_________(填入正確選項前的字母)。
A.500mL B. 250 mL C.10O mL D.50 mL
(4)若步驟4的粗產品經進一步精制得到5.7mL的溴苯,則該實驗中溴苯的產率是___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】與氫氣完全加成后,不可能生成2,2,3—三甲基戊烷的烴是( )
A.HC![]() CCH(CH3)C(CH3)3 B.CH2==CHC(CH3)2CH(CH3)2
CCH(CH3)C(CH3)3 B.CH2==CHC(CH3)2CH(CH3)2
C.(CH3)3CC(CH3)==CHCH3 D.(CH3)3CCH(CH3)CH==CH2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】ClO2是一種廣譜型的消毒劑。工業(yè)上ClO2常用NaClO3和NaSO3溶液并加H2SO4酸化后反應制得,在以上反應中NaClO3和Na2SO3的個數之比為( )
A. 1:1 B. 2:1 C. 1:2 D. 2:3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】肉桂醛是一種實用香精,它廣泛用于牙膏、洗滌劑、糖果以及調味品中。工業(yè)上可通過下列反應制備:下列相關敘述正確的是

①B的相對分子質量比A大28
②A、B可用酸性高錳酸鉀溶液鑒別
③B中含有的含氧官能團是醛基、碳碳雙鍵
④A、B都能發(fā)生加成反應、還原反應
⑤A能發(fā)生銀鏡反應
⑥A中所有碳原子一定處于同一平面
A.①④⑤ B.④⑤⑥ C.②③⑤ D.②③④⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作或方法中,正確的是( )
A. 海水淡化 ------蒸餾 B. 將碘單質從沙子提取出來--------過濾
C. 鹽水中獲得食鹽--------萃取分液 D. 稀釋濃硫酸時將水慢慢加入濃硫酸中
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在有機物 ①![]() ;② CH2=CH2;③CH≡CH;④
;② CH2=CH2;③CH≡CH;④![]() ;⑤
;⑤![]() ;
;
⑥![]() ;⑦ CH3CH2CH2CH2Br中能與NaOH溶液反應,但不能與Na2CO3溶液反應的是__________。 (填寫上述物質的序號)
;⑦ CH3CH2CH2CH2Br中能與NaOH溶液反應,但不能與Na2CO3溶液反應的是__________。 (填寫上述物質的序號)
(2)![]() 的系統(tǒng)命名為:________________________
的系統(tǒng)命名為:________________________
(3)現有下列A、B兩組物質:
A組:CH3—CHCl—CH3、![]() 、HCOOH、 ④CH3COOC2H5。
、HCOOH、 ④CH3COOC2H5。
B組:CH3CH2CH2OH、銀氨溶液、KOH溶液、④Na2CO3溶液。
A組中____________能跟B組中所有物質都可發(fā)生反應。(填寫上述物質的序號)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】閱讀下文,回答問題。
甲烷是天然氣、沼氣、油田氣和煤礦坑道氣的主要成分,世界20%的能源需求由它提供。
甲烷是重要的工業(yè)原料。甲烷高溫分解可得炭黑,常用作顏料、油墨、油漆以及橡膠的添加劑;甲烷還是乙炔、氫氰酸及甲醛等重要物質制備的原料;甲烷還可以制取氯仿(三氯甲烷)和四氯化碳等有機溶劑。
天然氣中除甲烷外,另有少量的乙烷、丙烷和丁烷,還有硫化氫、二氧化碳、氮氣、水汽和少量一氧化碳等。丙烷俗稱“高能氣”,2008年北京奧運祥云火炬就是用丙烷作為燃料的。丙烷價格低廉,可燃溫度范圍寬,燃燒火焰呈亮黃色易識別,燃燒產物無污染。它是一種清潔燃料,特別符合“綠色奧運”的理念。天然氣中另一種成分丁烷也有重要用途,可用作冷凍劑和氣體打火機燃料,也是制取多種有機物的重要原料。
目前沼氣在我國農村也有著廣泛的應用。人們在一定的溫度、濕度、pH條件下,將秸稈、雜草、人畜糞便等堆積在發(fā)酵池中,經隔絕空氣發(fā)酵產生沼氣。現在我國農村通過修建沼氣池,不但增加了高效清潔燃料,改善了農村居住環(huán)境,而且發(fā)酵池中還可以產生優(yōu)良的液體肥料,一舉多得。

(1)天然氣中除含甲烷外,還含有______________________________________等有機物。
(2)甲烷高溫分解得到炭黑的化學方程式是______________________________________。
(3)氯仿的結構式是______________________________。
(4)北京奧運火炬選擇丙烷作氣體燃料的原因是______________(填序號)。
a.可燃溫度范圍寬 b.價格低廉
c.燃燒產物沒有污染 d.燃燒的火焰顏色易識別
(5)乙烷與氯氣生成一氯乙烷的化學方程式是____________________________________。
(6)下列說法正確的是______________(填序號)。
a.煤礦坑道中嚴禁明火
b.丁烷可作氣體打火機的燃料
c.發(fā)酵池中只產生沼氣
d.發(fā)酵池中可利用的原料有秸稈、雜草、人畜糞便等
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com