
【題目】如圖裝置中,容器甲內充入0.1 mol NO氣體。干燥管內裝有一定量Na2O2,從A處緩慢通入CO2氣體。恒溫下,容器甲中活塞緩慢由D處向左移動,當移至C處時容器體積縮至最小,為原體積9/10,干燥管中物質的質量增加了2.24 g。隨著CO2的繼續通入,活塞又逐漸向右移動。下列說法中正確的是

A. 活塞從D處移動到C處的過程中,通入的CO2氣體為2.24 L(標準狀況)
B. NO2轉化為N2O4的轉化率為20%
C. 容器甲中NO已反應完
D. 活塞移至C處后,繼續通入a mol CO2,此時活塞恰好回至D處,則a小于0.01
【答案】D
【解析】
本題主要考查過氧化鈉與二氧化碳反應,NO與氧氣反應,2NO2![]() N2O4以及化學平衡的相關計算。CO2通入時,干燥管中發生反應:2Na2O2+2CO2===4NaOH+O2,C中發生反應:2NO+O2===2NO2
N2O4以及化學平衡的相關計算。CO2通入時,干燥管中發生反應:2Na2O2+2CO2===4NaOH+O2,C中發生反應:2NO+O2===2NO2![]() N2O4,導致氣體體積減小。
N2O4,導致氣體體積減小。
A.根據干燥管中固體物質的質量增加量計算通入的CO2體積;
B.根據O2計算出生成的NO2物質的量,再根據體積變化計算出轉化的NO2物質的量,從而計算出轉化率;
C.根據O2物質的量計算反應的NO;
D.因繼續通入CO2時,體積不會縮小,即干燥管中Na2O2已反應完,活塞向右移動,2NO2![]() N2O4平衡向左移動,由此判斷a值。
N2O4平衡向左移動,由此判斷a值。
A.設通入標準狀況下CO2氣體的體積為x,產生氧氣的體積為y,則:
2Na2O2+2CO2===2Na2CO3+O2 質量裝置△m
2×22.4 L 22.4 L 56 g
x y 2.24 g
所以56 g:2.24g=2×22.4 L:x,解得x=1.792L,56 g:2.24g=22.4 L:y,解得:y=0.896L,即:通入二氧化碳的體積為1.792L,故A錯誤;
B.由A計算可知,生成氧氣的物質的量:n(O2)=![]() =0.04mol,
=0.04mol,
2NO+O2===2NO2
2 1 2
0.08mol 0.04 mol0.08 mol
0.1 mol>0.08 mol,所以NO過量,生成NO2的物質的量為0.08 mol,
2NO2![]() N2O4 物質的量減少△n
N2O4 物質的量減少△n
2 1 1
0.02 mol 0.1 mol×(1-![]() )=0.01mol
)=0.01mol
所以NO2轉化為N2O4的轉化率為:![]() ×100%=25%,故B錯誤;
×100%=25%,故B錯誤;
C.根據B的計算可知,NO還剩余:0.1mol-0.08mol=0.02mol,故C錯誤;
D.活塞移至C,體積不會再減少,則干燥管中Na2O2已反應完,活塞由C向D移動,體積擴大,2NO2![]() N2O4平衡左移,使二者物質的量增多,活塞移至D時,氣體物質的量共增加0.01 mol,因此所需CO2必小于0.01 mol,故D正確。
N2O4平衡左移,使二者物質的量增多,活塞移至D時,氣體物質的量共增加0.01 mol,因此所需CO2必小于0.01 mol,故D正確。


科目:高中化學 來源: 題型:
【題目】A、B、C、D、E是核電荷數依次增大的五種短周期主族元素,A元素的原子核內只有1個質子,B元素的原子半徑是其所在主族中最小的,B的最高價氧化物對應水化物的化學式為HBO3;C元素原子的最外層電子數比次外層多4個;C的陰離子與D的陽離子具有相同的電子排布,兩元素可形成化合物D2C;C、E同主族。
(1)C在周期表中的位置____________________;
(2)由A、B、C三種元素形成的離子化合物的化學式為______________________。
(3)元素C、D、E形成的離子半徑大小關系是___________________(用離子符號表示).
(4)用電子式表示化合物D2C的形成過程____________________________________。
C、D還可形成化合物D2C2,D2C2含有的化學鍵是_____________________________。其主要用途有______________________。
(5)現有空氣中加熱片刻生成的D的氧化物(假定全為D2C2和D2C的混合物)a克,與VLHCl反應至中性,則HCl的濃度取值范圍為________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法錯誤的是( )
A. 一定溫度下,弱酸的電離常數越大,酸性越強
B. 醋酸的電離常數Ka和醋酸鈉的水解常數Kh之間的關系為:Ka·Kh=Kw
C. 平衡常數只受溫度影響,與反應物或生成物的濃度無關
D. 合成氨的反應,正反應的平衡常數和逆反應的平衡常數相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】目前世界上60%的鎂是從海水中提取的。海水提鎂的主要流程如下:
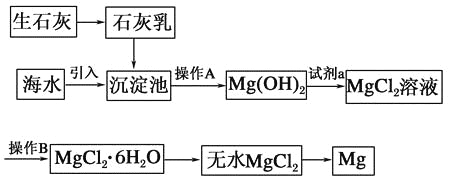
請回答下列問題:
(1)從離子反應的角度思考,在海水中加入石灰乳的作用是________,寫出在沉淀池中發生反應的離子方程式:_________________________________________________。
(2)石灰乳是生石灰與水形成的化合物,從充分利用海洋化學資源,提高經濟效益的角度考慮,生產生石灰的主要原料來源于海洋中的________。
(3)操作A是________,操作B是________。
(4)加入的足量試劑a是________(填化學式)。
(5)無水MgCl2在熔融狀態下,通電后會產生Mg和Cl2,該反應的化學方程式為________,從考慮成本和廢物循環利用的角度,副產物氯氣可以用于________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中肯定錯誤的是( )
A. 某原子K層上只有一個電子
B. 某原子M層上電子數為L層上電子數的4倍
C. 某離子M層上和L層上的電子數均為K層的4倍
D. 某離子的核電荷數與最外層電子數相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列推理正確的是
A. 鋁粉在氧氣中燃燒生成Al2O3,鐵絲在氧氣中燃燒也生成Fe2O3
B. 鐵能從硫酸銅溶液中置換出銅,鈉也能從硫酸銅溶液中快速置換出銅
C. 鋁片表面易形成致密的氧化膜,鈉塊表面也易形成致密的氧化膜
D. 鈉與氧氣、水等反應時鈉均作還原劑,金屬單質參與氧化還原反應時金屬均作還原劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(題文)常溫下,某水溶液M中存在的離子有Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根據題意回答下列問題:
(1)寫出酸H2A的電離方程式_________________________。
(2)若溶液M由10 mL 2 mol·L-1NaHA溶液與10 mL 2 mol·L-1 NaOH溶液等體積混合而成,則溶液M的pH________(填“<”“>”或“=”)7,溶液中離子濃度由大到小的順序為______________。已知Ksp(BaA)=1.8×10-10,向該溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+濃度為________mol·L-1。
(3)若有下列三種溶液:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl與0.04 mol·L-1的NaHA溶液等體積混合,則三種情況下,溶液中c(H2A)最大的是____________;pH由大到小的順序為______________。
(4)若溶液M由pH=3的H2A溶液V1 mL與pH=11的NaOH溶液V2 mL混合反應而得,混合溶液中![]() =104,V1與V2的大小關系為________(填“V1大于V2”“V1等于V2”“V1小于V2”或“均有可能”)。
=104,V1與V2的大小關系為________(填“V1大于V2”“V1等于V2”“V1小于V2”或“均有可能”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com