
【題目】有A、B、C、D、E五種短周期元素,它們的原子序數(shù)依次增大。已知A和C、B和D分別位于同主族,且B、D質(zhì)子數(shù)之和是A、C質(zhì)子數(shù)之和的2倍;![]() 在同周期元素中原子半徑最小。
在同周期元素中原子半徑最小。
(1)B形成的雙原子分子中,共價(jià)鍵的類(lèi)型有__,化合物A2B中B原子采取__雜化。
(2)A2B和A2D的沸點(diǎn)較高者是__(填化學(xué)式),其原因是_。
(3)E原子的電子排布式為__。
(4)寫(xiě)出均由A、B、C、D四種元素組成的兩物質(zhì)的濃溶液發(fā)生反應(yīng)的離子方程式:__。
【答案】σ鍵、π鍵 sp3 H2O 水分子間能形成氫鍵,使其沸點(diǎn)高于H2S 1s22s22p63s23p5(或[Ne]3s23p5) H++HSO3-=H2O+SO2↑
【解析】
有A、B、C、D、E五種短周期元素,它們的原子序數(shù)依次增大,A和C、B和D分別位于同主族,且B、D質(zhì)子數(shù)之和是A、C質(zhì)子數(shù)之和的2倍,則A是H元素,C是Na元素,因此B是O元素,D是S元素,E在同周期元素中原子半徑最小,且為主族的短周期元素,所以E是Cl元素,據(jù)此分析解答。
依據(jù)上述分析可知:A為氫,B為氧,C為鈉,D為硫,E為氯。
(1)O形成的雙原子分子是氧氣,氧氣分子的結(jié)構(gòu)式為O=O,從軌道重疊的角度來(lái)看共價(jià)鍵的類(lèi)型有頭對(duì)頭的σ鍵和肩并肩的π鍵;化合物A2B為H2O,H2O中O原子的價(jià)層電子對(duì)個(gè)數(shù)=2+![]() =4,含有2個(gè)孤電子對(duì),所以H2O的VSEPR模型為四面體,分子空間構(gòu)型為V型,中心原子雜化方式為sp3,故答案為:σ鍵和π鍵;sp3;
=4,含有2個(gè)孤電子對(duì),所以H2O的VSEPR模型為四面體,分子空間構(gòu)型為V型,中心原子雜化方式為sp3,故答案為:σ鍵和π鍵;sp3;
(2)H2O分子間存在氫鍵而H2S分子間不存在氫鍵,故H2O的沸點(diǎn)比H2S高,故答案為:H2O;水分子間能形成氫鍵,使其沸點(diǎn)高于H2S;
(3)E是Cl元素,其原子核外有17個(gè)電子,根據(jù)構(gòu)造原理知,Cl原子的電子排布式為1s22s22p63s23p5,故答案為:1s22s22p63s23p5 ;
(4)由H、O、Na、S四種元素組成的兩物質(zhì)分別為:硫酸氫鈉和亞硫酸氫鈉,它們的濃溶液發(fā)生反應(yīng)的離子方程式:H++HSO3-=H2O+SO2↑,故答案為:H++HSO3-=H2O+SO2↑。


 閱讀快車(chē)系列答案
閱讀快車(chē)系列答案
| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來(lái)源: 題型:
【題目】常溫下,向1L 0.1mol·L1一元酸HR溶液中逐漸通入氨氣(已知常溫下NH3·H2O電離平衡常數(shù)K=1.76×10-5),使溶液溫度和體積保持不變,混合溶液的pH與離子濃度變化的關(guān)系如圖所示。下列敘述正確的是
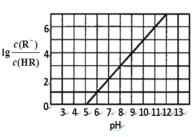
A.當(dāng)c(R-)=c(HR)時(shí),溶液必為中性
B.0.1mol·L-1HR溶液的pH為5
C.HR為弱酸,常溫時(shí)隨著氨氣的通入,![]() 逐漸增大
逐漸增大
D.當(dāng)通入0.1 mol NH3時(shí),c(NH4+)>c(R-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】氫是重要而潔凈的能源。要利用氫氣作為能源,必須解決好儲(chǔ)存氫氣的問(wèn)題。化學(xué)家研究出利用合金儲(chǔ)存氫氣的方法,其中鑭(La)鎳(Ni)合金是一種儲(chǔ)氫材料,這種合金的晶體結(jié)構(gòu)已經(jīng)測(cè)定,其基本結(jié)構(gòu)單元如圖所示,則該合金的化學(xué)式可表示為( )
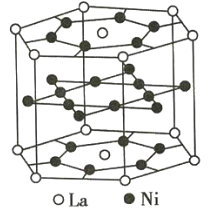
A.LaNi5B.LaNiC.La14Ni24D.La7Ni12
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】根據(jù)雜化軌道理論和價(jià)電子對(duì)互斥理論模型判斷,下列分子或離子的中心原子雜化方式及空間構(gòu)型正確的是( )
選項(xiàng) | 分子或離子 | 中心原子雜化方式 | 價(jià)電子對(duì)互斥理論模型 | 分子或離子的空間構(gòu)型 |
A | H2O | sp1 | 直線(xiàn)形 | 直線(xiàn)形 |
B | BBr3 | sp2 | 平面三角形 | 三角錐形 |
C | PCl3 | sp2 | 四面體形 | 平面三角形 |
D | CO32- | sp2 | 平面三角形 | 平面三角形 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】短周期主族元素W、X、Y、Z的原子序數(shù)依次增大,W、X原子的最外層電子數(shù)之比為4∶3,Z原子的核外電子數(shù)比X原子多4。下列說(shuō)法正確的是( )
A.W、Y、Z的電負(fù)性大小順序一定是Z>Y>W
B.Z的氫化物分子間存在氫鍵
C.Y、Z形成的化合物分子的中心原子可能采取sp3雜化
D.WY2分子中σ鍵與π鍵的數(shù)目之比一定是2∶1
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】有關(guān)晶體的結(jié)構(gòu)如圖所示,下列說(shuō)法中不正確的是
A.  在NaCl晶體中,距Na+最近的Cl-形成正八面體
在NaCl晶體中,距Na+最近的Cl-形成正八面體
B.  在CaF2晶體中,每個(gè)晶胞平均占有4個(gè)Ca2+
在CaF2晶體中,每個(gè)晶胞平均占有4個(gè)Ca2+
C.  在金剛石晶體中,碳原子與碳碳鍵數(shù)目比為1∶2
在金剛石晶體中,碳原子與碳碳鍵數(shù)目比為1∶2
D.  由E原子和F原子構(gòu)成的氣態(tài)團(tuán)簇分子的分子式為EF或FE
由E原子和F原子構(gòu)成的氣態(tài)團(tuán)簇分子的分子式為EF或FE
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】某原子晶體的空間結(jié)構(gòu)中的一部分如圖所示。該原子晶體與某物質(zhì)B反應(yīng)生成C,其實(shí)質(zhì)是在每個(gè)A—A鍵中插入一個(gè)B原子,則C的化學(xué)式為( )
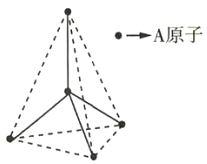
A.ABB.A5B4C.AB2D.A2B5
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】下列物質(zhì)發(fā)生變化時(shí),所克服的粒子間作用力屬于同種類(lèi)型的是( )
A.碘與干冰受熱變?yōu)闅怏w
B.硝酸銨與硝酸受熱分解變?yōu)闅怏w
C.氯化鈉與氯化氫溶解在水中
D.晶體鈉熔化與冰融化
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
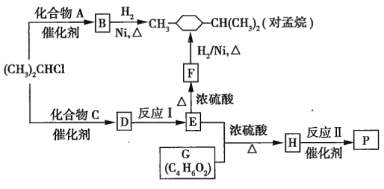
【題目】優(yōu)良的有機(jī)溶劑對(duì)孟烷、耐熱型特種高分子功能材料![]() 的合成路線(xiàn)如圖所示:
的合成路線(xiàn)如圖所示:
已知芳香化合物苯環(huán)上的氫原子可被鹵代烷中的烷基取代,如:![]() (
(![]() 為烷基,
為烷基,![]() 為鹵素原子)。
為鹵素原子)。
(1)已知B為芳香烴。
①由B生成對(duì)孟烷的反應(yīng)類(lèi)型是__________________。
②![]() 與A反應(yīng)生成B的化學(xué)方程式是_________________。
與A反應(yīng)生成B的化學(xué)方程式是_________________。
③![]() 的同系物中相對(duì)分子質(zhì)量最小的物質(zhì)是_________________________。
的同系物中相對(duì)分子質(zhì)量最小的物質(zhì)是_________________________。
(2)已知![]() 的分子式為
的分子式為![]() 且含有一個(gè)酚羥基,且苯環(huán)上的另一個(gè)取代基與酚羥基處于間位;
且含有一個(gè)酚羥基,且苯環(huán)上的另一個(gè)取代基與酚羥基處于間位;![]() 不能使
不能使![]() 的
的![]() 溶液褪色。
溶液褪色。
①F中含有的官能團(tuán)名稱(chēng)是_____________________。
②C的結(jié)構(gòu)簡(jiǎn)式是________________。
③反應(yīng)I的化學(xué)方程式是________________。
(3)G的核磁共振氫譜有3個(gè)峰,其峰面積之比為![]() ,且G與
,且G與![]() 溶液反應(yīng)放出
溶液反應(yīng)放出![]() 。寫(xiě)出反應(yīng)Ⅱ的化學(xué)方程式:_________________________________。
。寫(xiě)出反應(yīng)Ⅱ的化學(xué)方程式:_________________________________。
查看答案和解析>>
國(guó)際學(xué)校優(yōu)選 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專(zhuān)區(qū) | 電信詐騙舉報(bào)專(zhuān)區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專(zhuān)區(qū) | 涉企侵權(quán)舉報(bào)專(zhuān)區(qū)
違法和不良信息舉報(bào)電話(huà):027-86699610 舉報(bào)郵箱:58377363@163.com